
题目列表(包括答案和解析)
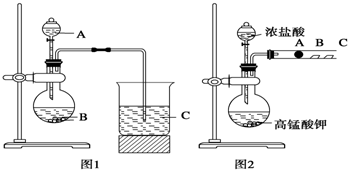
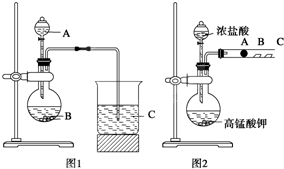
| 实验 编号 |
KClO3/g | 氧化物 | 产生气体/mL (已折算到标况) |
耗时/s | ||
| 化学式 | 质量/g | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 90% | 67.2 | 188.3 |
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 | 立即剧烈反应 |
开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 |
有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol?L-1盐酸的试管中加入大小相同的镁片和铝片 | 镁、铝与盐酸反应产生气泡剧烈程度不同 | 镁与盐酸反应产生气泡速率较快 |
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) | 耗时(s) | ||
| 化学式 | 质量(g) | 回收 | (已折算到标况) | |||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com