
(2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe
2O
3)的废铁屑来制取FeCl
3?6H
2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
操作步骤如下:
Ⅰ.打开弹簧夹K
1、关闭弹簧夹K
2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K
1、打开弹簧夹K
2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl
3?6H
2O晶体.请回答:
(1)A中发生的置换反应的化学方程式是
Fe+2HCl=FeCl2+H2
Fe+2HCl=FeCl2+H2
.
(2)操作Ⅱ中“…”的内容是
当A中固体完全消失
当A中固体完全消失
,烧杯中的现象是
无色溶液逐渐变黄
无色溶液逐渐变黄
,相应的离子方程式和化学方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
、
.
(3)操作Ⅲ不采用直接加热制FeCl
3?6H
2O晶体的原因是
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
(用简要文字并结合离子方程式解释).
(4)测得B中所得的气体是V mL(标准状况时),由此计算出该废铁屑中铁的质量分数是
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
.
(5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg.由此求出铁的准确质量分数是
(用含m、和w的式子表示).

 A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.
A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.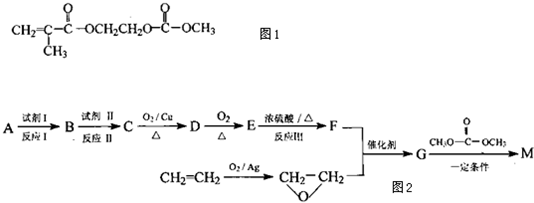
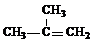
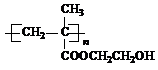
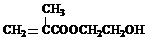
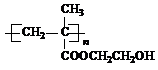
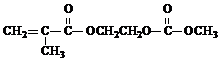 +3NaOH→
+3NaOH→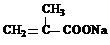 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH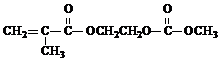 +3NaOH→
+3NaOH→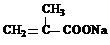 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH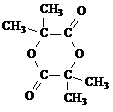
 (2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
(2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):