
题目列表(包括答案和解析)

 为混合物中CO的含量,T为温度)。
为混合物中CO的含量,T为温度)。 

反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1= a kJ·mol-1
反应② CO(g)+1/2O2(g)===CO2(g);△H2= b kJ·mol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
![]()
(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。 在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂
(3)下列图像符合反应①的是 (填序号)(图中v是速率、![]() 为混合物中CO的含量,T为温度)。
为混合物中CO的含量,T为温度)。
 |
(4)由反应①和②可求得反应2Fe(s)+O2(g)===2FeO(s) △H3中的△H3= (用含a、b的代数式表示)。
(5)如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
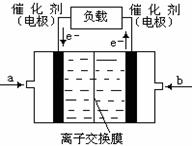 (填“甲醇”或“氧气”),b处电极上发生的电极反应是:
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:


①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极;
②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O =Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)已知FeCl3在反应中得到电子,则该反应的还原剂是 。
(2)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①电解质溶液X是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(3)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:

①M是 极;
②图丙中的②线是____离子的变化。当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:

①图中X溶液是 ;
②石墨电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极; ②图丙中的②线是 的变化。
③当电子转移为2 mol时,向乙烧杯中加入 L 5 mol·L-1 NaOH溶液才能使Cu2+沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com