
题目列表(包括答案和解析)
等体积混合0.10 mol·L-1盐酸和0.06 mol·L-1Ba(OH)2溶液后,溶液的pH等于
A.2.0 B.12.3 C.1.7 D.12.0
等体积混合0.10 mol·L-1盐酸和0.06 mol·L-1Ba(OH)2溶液后,溶液的pH等于
A.2.0 B.12.3 C.1.7 D.12.0
等体积混合0.10 mol·L-1盐酸和0.06 mol·L-1Ba(OH)2溶液后,溶液的pH等于
A.2.0 B.12.3 C.1.7 D.12.0
50 ml 1.0 mol·L-1盐酸与50 mL 1.1 mol·L-1 NaOH溶液在如下图1所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.回答下列问题:

①从实验装置上看,大烧杯上没有________,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”);实验装置中也缺少环形玻璃搅拌棒,若用环形铜质搅拌棒代替,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”).
②若实验中分多次把NaOH溶液倒入盛有盐酸的小烧杯中,则求得的中和热数值________(填“偏大”“偏小”或“无影响”)
③若实验中改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),该实验中NaOH溶液的浓度大于盐酸浓度的作用是________.
④若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”).
⑤当室温低于10℃时进行实验,对实验结果会造成较大误差,其原因是________.
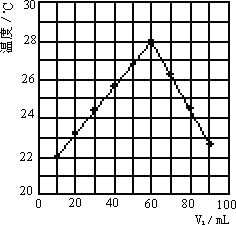
⑥若将V2mL未知浓度的NaOH溶液,加入内盛有V1mL 1.0 mol/L HCl溶液的小烧杯中混合均匀后测量并记录溶液温度,且每次实验中均保持V1+V2=100 mL,实验结果如下图2所示(以温度为纵坐标,V1为横坐标).做该实验时环境温度________22℃(填<、=、>),NaOH溶液的浓度约为________mol/L
将10 mL 0.50 mol·L-1的一元酸HA溶液和等体积0.10 mol·L-1 KOH溶液混合后,稀释至100 ml,它的pH=3.00.
(1)通过计算说明HA是弱酸还是强酸?
(2)如果是弱酸,它的电离平衡常数是多少?电离度是多少?
(3)在该溶液中加入0.010 mol可溶性镁盐固体,是否有沉淀产生?沉淀为何种物质?(Ksp(Mg(OH)2)=1.8×10-11,Ksp(MgA2)=6.4×10-9)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com