
题目列表(包括答案和解析)
某实验的实验装置如右图所示,回答下列有关该实验的问题。

(1)该实验所用的石墨棒须经过预处理:先经高温火焰灼烧到红热,再迅速浸入冷水中。这种预处理的目的是 。
(2)要使发光二极管发亮,实验时的操作顺序是 。
(3)断开S1,闭合S2后的各电极的反应式 。
(6分)下列说法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
17..(18分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯:
 已知:
已知:
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,
导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和
食盐水,振荡、静置、分层,环己烯在 层(填
“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。
蒸馏时要加入生石灰,目的是: 。
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 ( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 ( )
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
18.(12分)有机
物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
19.(16分)肉
桂酸甲酯( )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
⑴肉桂酸甲酯的分子式是 ;
 ⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
A.能与溴的四氯化碳溶液发生加成反应
B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.不可能发生加聚反应
⑶G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为 ;
⑷用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有 (填名称)。
②F→G的反应类型是 ,该反应的化学方程式为 _ _ 。
③C→D的化学方程式为 _。
④写出符合下列条件的F的同分异构体的结构简式 。O%M
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
20.(10分)有机物A的蒸汽对同温同压下氢气的相对密度为31,取3.1克A物质在足量氧气中充分燃烧,只生成2.7克水和标准状况下CO22.24L,求有机物的分子式;若该有机物0.2mol恰好与9.2克金属钠完全反应,请写出有机物的结构简式并命名。
I下列实验设计、操作或实验现象合理的是_________(填序号)
A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
 II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
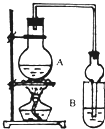
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有过量乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
(1)A中浓硫酸的作用是
反应中加入的乙醇是过量的,其目的是________________________________。
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式 ;
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是_______________________ 。
(4)反应结束后D中的现象是 。
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| …… | …… | …… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com