
题目列表(包括答案和解析)
| A、碱金属元素中,金属活泼性最强的是Li | B、第三周期元素中,原子半径最大的是Cl | C、短周期元素氧化物对应的水化物中,酸性最强的是H2SO4 | D、所有元素的气态氢化物中,最稳定是HF |
| A、HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | B、元素R最高正价为+7价,表明R元素属于ⅦA族元素 | C、若M+和R2-具有相同的电子层结构,则原子半径:M<R | D、从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 |
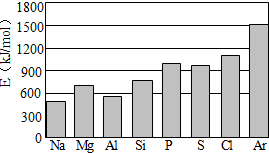 根据元素周期表及周期律的知识回答下列问题:
根据元素周期表及周期律的知识回答下列问题:| 一定条件 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com