
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe
2O
3(s)+3CO(g)═2Fe(s)+3CO
2(g)△H=-24.8kJ?mol
-13Fe
2O
3(s)+CO(g)═2Fe
3O
4(s)+CO
2(g)△H=-47.4kJ?mol
-1Fe
3O
4(s)+CO(g)═3FeO(s)+CO
2(g)△H=+640.5kJ?mol
-1写出CO气体还原FeO固体得到Fe 固体和CO
2气体的热化学反应方程式:
CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218.0kJ/mol
CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218.0kJ/mol
.
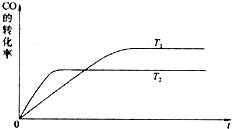
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H
2在催化剂作用下反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H
<
<
0(填“<”、“>”或“=”).
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H
2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”).
(3)实验室中配制AgNO
3溶液时通常需要向其中加入
硝酸
硝酸
,目的是
抑制Ag+水解
抑制Ag+水解
; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag
+(aq)+Cl
-(aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol?L
-1AgNO
3溶液;③100mL 0.1mol?L
-1氯化镁溶液;④100mL 0.1mol?L
-1氯化钠溶液.充分搅拌后,相同温度下Ag
+浓度由大到小的顺序是
②①④③
②①④③
(填写序号).

 (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式: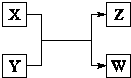 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.