
题目列表(包括答案和解析)
(1)写出名称和元素符号:A.________,B.________,C.________,D.________,E.________。
(2)写出AC的电子式和用电子式表示ED2的形成过程。
(3)写出这五种元素最高价氧化物的水化物的化学式,并分析其酸碱性。
(4)写出这些元素中能形成气态氢化物的化学式,比较其稳定性。
A,B,C,D,E五种元素的原子序数依次递增,且它们位于前四周期。已知A,C两元素的电子层数相同,A,E两元素的最外层和次外层电子数也相同。A和C形成化合物AC,D和E形成化合物ED2,B与D形成化合物BD3。
(1)写出名称和元素符号:A.________,B.________,C.________,D.________,E.________。
(2)写出AC的电子式和用电子式表示ED2的形成过程。
(3)写出这五种元素最高价氧化物的水化物的化学式,并分析其酸碱性。
(4)写出这些元素中能形成气态氢化物的化学式,比较其稳定性。
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。

(1)B,D可分别与A形成只含一个中心原子的共价化合物X和Y,其中X的电子式为 ;Y采取的杂化轨道类型为 ;C与A形成的常见化合物的分子构型为 。
(2)B和D的最高价氧化物的晶体中熔点较高的是(填化学式) ,其原因 。
(3)B与C比较电负性较大的是 (填元素符号),E2+的核外电子排布式为 。
(4)E2+与C的常见氢化物形成的配离子的离子反应方程式为 。
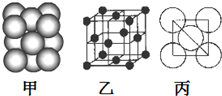
(5)铝单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。若已知铝原子半径为d,NA表示阿伏加德罗常数,摩尔质量为M,则该原子的配位数 ,该晶体的密度可表示为______________,据下图计算,Al原子采取的面心立方堆积的空间利用率为 __________。
有A,B,C,D,E五种元素,它们的原子序数依次增大.
①D的氢化物化学式为H2D,D的最高价氧化物中含D40%,且D原子核内的质子数和中子数相等.
②A原子的最外层电子数是次外层电子数的2倍;B的阴离子和C的阳离子与氖原子的电子层结构相同;E原子的最外层电子数比次外层电子数少1,比倒数第三层上的电子数多5.
③在常温常压下,B的单质是气体,0.1mol B的单质与足量的氢气反应时有0.4NA个电子转移.
④C的单质在B的单质中充分燃烧生成淡黄色固体,此固体与AB2反应又能生成B的单质.
根据上面叙述,回答下列问题:
(1)A,B,C,D,E的元素符号分别为________.
(2)C位于周期表中第________周期________族.
(3)A,C,D,E最高价氧化物对应水化物的化学式为________,________,________,________.
(4)C单质在B单质中燃烧生成的淡黄色固体的电子式为________,此固体与AB2反应的化学方程式为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com