
题目列表(包括答案和解析)

| 36cV×10-3 |
| a |
| 36cV×10-3 |
| a |
(12分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:
![]() ① 在潮湿空气中CaO2能够发生反应:
① 在潮湿空气中CaO2能够发生反应:
CaO2+2H2O → Ca(OH)2+H2O2 2CaO2+2CO2 → 2CaCO3+O2
![]() ② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
![]() 在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2。CaO2?8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2。CaO2?8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
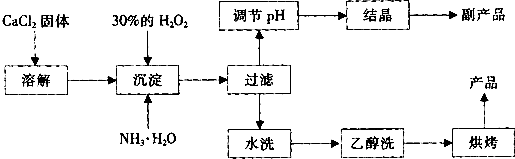
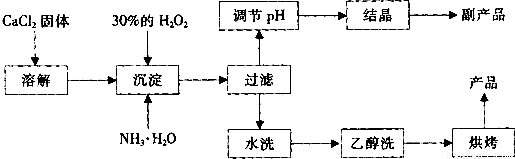
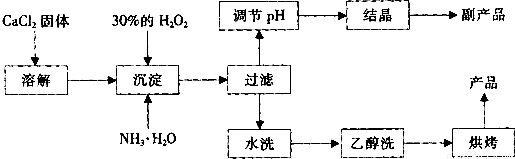
![]() 其制备过程如下:
其制备过程如下:

根据以上信息,回答下列问题:w.w.w.k.s.5.u.c.
(1)用上述方法制取CaO2?8H2O的化学方程式是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
(4)为了检验“水洗”是否合格的方法是
![]()
(5)测定产品中CaO2的含量的实验步骤是:
![]() 第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶
液,充分反应。
![]()
第二步:向上述锥形瓶中加入几滴淀粉溶液。
![]()
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
![]() 【已知:I2+2S2O32-= 2I-+S4O62-(无色)】
【已知:I2+2S2O32-= 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 ;
![]()
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com