某化学小组在讨论鉴别稀酸和浓硫酸的实验时,设计了如下表格.请按照给出的甲方案的式样,写出另外三种不同的鉴别方法.
| 方案 |
操作 |
结论 |
| 甲 |
分别加入到盛水的试管中 |
放热者为浓硫酸 |
| 乙 |
|
|
| 丙 |
|
|
| 丁 |
|
|
(1)甲、乙两同学欲对上述整套装置检查气密性:
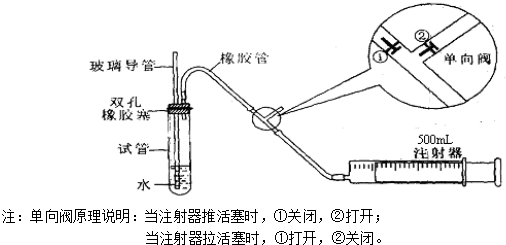
甲同学是用手捂住试管(或微热试管),观察导管中是否有液面上升的现象.是否能?
(填能或不能);
乙同学是先从玻璃导管向试管中注入水,观察导管中液面与试管中液面是否形成高度差,且在一段时间后,观察液面差是否变化的方法.是否能?
(填能或不能);
若上述两种方案均不能,请思考新方案,并填下列空白(若上述可行,则不填下列空白):先在试管中装入适量水(保证玻璃导管的下端浸没在水中),然后(填操作方法)
,看到
(填实验现象),证明该装置的气密性良好.
(2)向试管中加入0.00127%的碘水10g,用适量的蒸馏水稀释后,再加入2~3滴淀粉溶液,配置成溶液A.测定指定地点空气中SO
2的含量时,推拉注射器的活塞反复抽气,试管中发生的化学反应方程式为SO
2+I
2+2H
2O=H
2SO
4+2HI,A溶液由
色变为
时表明反应恰好完全进行,此时应停止抽气.
(3)我国环境空气质量标准中对每次空气质量测定中SO
2的最高浓度限值(mg/m
3):一级标准:0.15;二级标准:0.50;三级标准:0.70.该课外活动小组分成第一活动小组和第二活动小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO
2的含量.当反应恰好完全进行,记录抽气时间和次数如下(假定每次抽气500mL).请将下表填写完整(计算时保留2位有效数字):
| 分组 |
第一小组 |
第二小组 |
| 抽气时间 |
20分钟 |
21分钟 |
| 抽气次数 |
100 |
130 |
| SO2含量mg/m3 |
|
|
①在实验过程中,需缓缓抽动活塞的目的是
;若快速抽拉,则测定的结果将
(填偏大、偏小或无影响);
②判断该地点的空气中SO
2含量属于
(填数字)级标准,
(填“第一”或“第二”)小组的测定结果准确,另一小组实验结果产生较大偏差的原因是
(两个小组所用药品和装置均无问题).


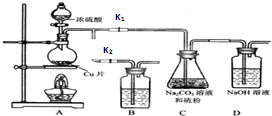 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-. 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇: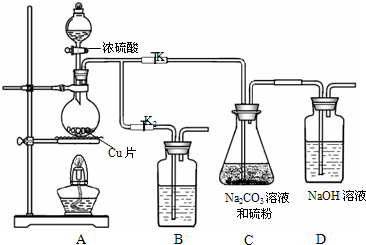
 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是