
题目列表(包括答案和解析)
已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:

①写出n (OH―)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
碱石灰的 可能组成 | NaOH、CaO | NaOH、CaO、 Ca (OH)2 | NaOH、 Ca (OH)2 | NaOH、 Ca (OH)2、H2O |
n (Na+)、n (Ca2+) 的关系 | 40x+56y = 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰中各成分的质量分数。

| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― | 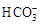 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案
| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― | 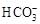 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― |
|
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
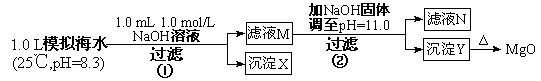
A.沉淀物X为CaCO3 B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
 |
| 模拟海水中的离 子  浓度(mol/L) 浓度(mol/L) | Na+[来 | Mg2+ | Ca2+ | Cl― | 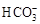 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com