
题目列表(包括答案和解析)
环戊酮的各种衍生物具有独特的性能,如α—正己基环戊酮具有清新天然果香气息,并带有较强烈的薄荷凉爽感,香气强度好,留香较持久,可用于牙膏香精、口香糖香精及各种略带凉味、果味的食用香精中。近年来,人们还发现了α—烃基环戊酮具有非常好的抗癌性能,如α—甲基环戊酮![]() 。其可以利用环己醇来合成,合成线路如下:
。其可以利用环己醇来合成,合成线路如下:
(1)写出A、B的结构简式。
A______________________________________B_________________________________
(2)浓硝酸氧化环己醇的反应是一个大量放热的反应,因此在实验中,能够观察到的明显现象是______________________________,为了充分利用原料,液体环己醇的加入方式是_____________________,实验中采用的硝酸浓度是50%,为什么不采用更大尝试的硝酸?_____________________________________________________。
(3)用5.3mL的环己醇和30mL 50%的硝酸制备己二酸(设硝酸的不愿产物为NO),试估算其理论产量。
环戊酮的各种衍生物具有独特的性能,如α—正己基环戊酮具有清新天然果香气息,并带有较强烈的薄荷凉爽感,香气强度好,留香较持久,可用于牙膏香精、口香糖香精及各种略带凉味、果味的食用香精中。近年来,人们还发现了α—烃基环戊酮具有非常好的抗癌性能,如α—甲基环戊酮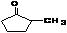 。其可以利用环己醇来合成,合成线路如下:
。其可以利用环己醇来合成,合成线路如下: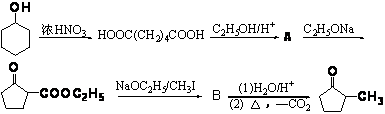
(1)写出A、B的结构简式。
A______________________________________ B_________________________________
(2)浓硝酸氧化环己醇的反应是一个大量放热的反应,因此在实验中,能够观察到的明显现象是______________________________,为了充分利用原料,液体环己醇的加入方式是_____________________,实验中采用的硝酸浓度是50%,为什么不采用更大尝试的硝酸?_____________________________________________________。
(3)用5.3mL的环己醇和30mL 50%的硝酸制备己二酸(设硝酸的不愿产物为NO),试估算其理论产量。
环己酮(微溶于水,易溶于醇和醚,沸点155.7℃)是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):

实验步骤如下:
①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.控制瓶内温度在55℃~60℃之间,充分反应0.5 h.
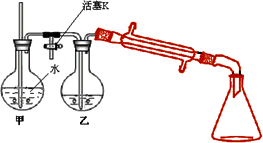
③向②反应后的圆底烧瓶内加入少量水,并接入右图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体分液,水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层.再向有机层中加入无水硫酸钠静置后转入干燥的圆底烧瓶中,进行蒸馏,除去乙醚后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是________.
(2)步骤③利用图示装置进行实验的目的是________,实验过程中要经常检查甲中玻璃管内的水位.若玻璃管内的水位升高过多,其可能原因是________,此时应立即采取的措施是________.
(3)步骤④中加入无水硫酸钠的作用是________,蒸馏除乙醚的过程中采用的加热方式为________.
(4)写出该实验中可能发生的一个副反应的化学方程式________
(12分)环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;
b 过滤;
c 在收集到的馏分中加NaCl固体至饱和,静置,分液;
d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 、 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
(12分) 环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
环己醇、环己酮和水的部分物理性质见下表:
|
物质 |
沸点(℃) |
密度(g-cm-3,20℃) |
溶解性 |
|
环己醇 |
161.1(97.8)* |
0.9624 |
能溶于水 |
|
环己酮 |
155.6(95)* |
0.9478 |
微溶于水 |
|
水 |
100.0 |
0.9982 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
 (1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
(1)酸性Na2Cr2O7溶液氧化环己醇为放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
 ②蒸馏不能分离环己酮和水的原因是 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;
b 过滤;
c 在收集到的馏分中加NaCl固体至饱和,静置,分液;
d 加入无水MgSO4固体,除去有机物中少量水。
 ①上述操作的正确顺序是
(填字母)。
①上述操作的正确顺序是
(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 、 。
 ③在上述操作c中,加入NaCl固体的作用是
。
③在上述操作c中,加入NaCl固体的作用是
。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com