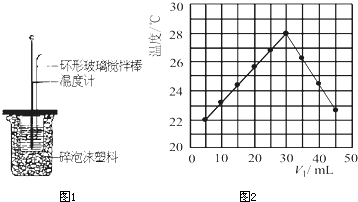
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液测定中和热.测定中和热的实验装置如图1所示.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):
NaOH(aq)+HCl (aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
NaOH(aq)+HCl (aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,数据如下表所示:
①请填写下表中的空白:
| 温度 |
起始温度t1/℃ |
终止温度
t1/℃ |
温度差
(t2-t1)t1/℃ |
| 实验次数 |
H2SO4 |
NaOH |
平均值 |
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
4.0 4.0 |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm
3,中和后生成溶液的比热容c=4.18J/(g?℃).则生成1molH
2O的△H=
-53.5kJ/mol
-53.5kJ/mol
kJ/mol(取小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是
①②③④
①②③④
(填字母).
①室温低于10℃时进行实验,②在量取NaOH溶液的体积时仰视读数,③分多次把NaOH溶液倒入盛有硫酸的小烧杯中,④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒.
(3)将V
1mL 0.4mol/L H
2SO
4溶液和V
2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V
1+V
2=50mL).下列叙述正确的是
BC
BC
A 做该实验时环境温度为22℃
B 该实验表明化学能可转化为热能
C NaOH溶液的浓度约为1.2mol/L
D 该实验表明有水生成的反应都是放热反应.



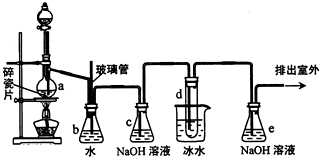 1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.
1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.