
题目列表(包括答案和解析)
(共4分)25℃时,PH = 10.0的KOH溶液中,由水电离出的(OH-)=____________mol/L;
pH = 12.0的KCN溶液中,由水电离出来的(H+)=______________mol/L。
(共4分)25℃时,PH = 10.0的KOH溶液中,由水电离出的(OH-)=____________mol/L;
pH = 12.0的KCN溶液中,由水电离出来的(H+)=______________mol/L。
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2 水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示
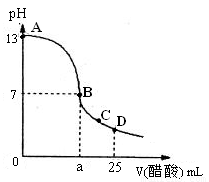
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a 12.5 mL(填“大于”、“小于”或“等于”)
(10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com