
题目列表(包括答案和解析)
25℃时, 已知反应:CO2(g) + H2(g) CO (g) + H2O (g) △H = + 41 kJ/mol。回答下列问题:
(1)该反应属于 反应(“放热”或“吸热”), 判断依据是
(2)能判断该反应是否已达平衡状态的依据是 (填序号)。
a.混合气体中n(CO)不变 b. v消耗(CO2) = v生成(CO)
c.混合气的总物质的量不变 d. 容器中压强不变 e. c(CO)= c(H2O)
(3)一定条件下的密闭容器中,反应达到平衡,要提高CO2的转化率,可以采取的措施是________(填序号)。
a.向体系中通入CO2 b.降低温度
c.向体系中通入惰性气体 d.向体系中通入H2 e.加入催化剂
(4)25℃时,已知: 2C(石墨) + O2 (g) = 2CO(g) △H1 = -222 kJ/mol
H2(g) + 1/2O2(g) = H2 O (g) △H2 = -242 kJ/mol
结合题中信息,写出石墨与氧气反应生成1mol CO2的热化学方程式
。
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g)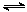 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)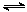 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示: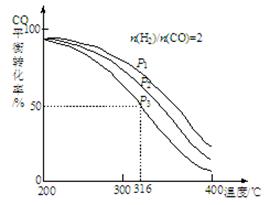
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,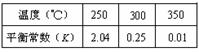
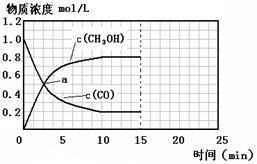
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1 CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1 CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:


实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)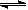 CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g)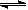 CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g)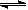 CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g)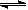 CH3OCH3(g)+CO2(g)的ΔH=__________ ,
CH3OCH3(g)+CO2(g)的ΔH=__________ ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) ? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应? N2O4(g)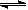 2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.

①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com