
题目列表(包括答案和解析)
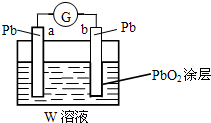 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.


| ||
| ||


(1)写出A、B、C、D四种元素的符号:A__________、B__________、C__________、D__________。
(2)在B
①均为周期表中前20号元素,A、B在同一主族,C、D在同一周期;
②相互间可组成B2C2、A2C、D C2等化合物;
③B的阳离子与C的阴离子核外电子排布相同;
④B2C2同A2C或者D C2反应都生成气体C2,B单质与A2C反应生成气体A2,气体A2与C2按照体积比2∶1混合,点火爆炸,完全化合成常温下无色、无味的液体A2C,请完成下面的问题。
(1)写出四种元素的符号:A_________;B_________;C_________;D_________。
(2)BCA的电子式为_________,其化学键的类型为__________________。
(3)B2C2与DC2反应的化学方程式为____________________________________________。
(4)B2C2与A2C的反应的化学方程式为__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com