
题目列表(包括答案和解析)
| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中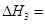 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲) C(SO2) (乙) C(SO2) (丙)(填“>”、“<”或“=”)。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率________,理由是________。
(2)保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是________________。
(3)保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是________________。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是________________。
(5)提高起始的反应温度,反应速率________,理由是________________。
(1)在一密闭容器中充入1 mol NO2,建立如下平衡:2NO2![]() N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1 mol NO2,待新平衡建立时,又测得NO2的转化率为b%.试问a、b值的大小关系为________.
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1 mol NO2,待新平衡建立时,又测得NO2的转化率为b%.试问a、b值的大小关系为________.
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是________.

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,试回答下列问题:
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为________.
②如把KOH改为稀H2SO4作电解质,则正极反应式为________.
③如把H2改为甲烷,KOH作电解质,则负极反应式为________.
(1)保持容器容积不变,向其中加入1 mol H2,反应速率________,理由是________。
(2)保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是________________。
(3)保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是________________。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是________________。
(5)提高起始的反应温度,反应速率________,理由是________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com