
题目列表(包括答案和解析)
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡气体总浓度(×10—3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为 。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
(13分)无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H2SO4(浓)===NaHSO4+HCl↑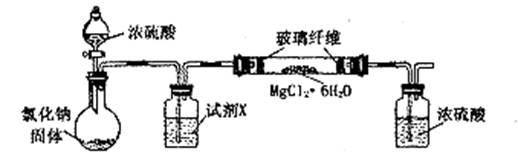
(1)试剂X是 。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·nH2O中n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | |
(13分) 无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H2SO4(浓)===NaHSO4+HCl↑
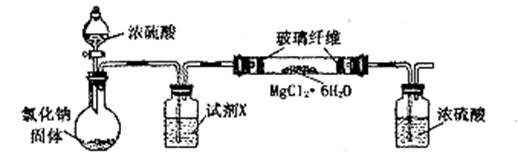
(1)试剂X是 。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·nH2O中n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
|
实验序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式 |
催化效果/g·g-1 |
|
1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
|
2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
|
3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
|
4 |
ω |
100 |
振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω= 。
(6)从实验1、2可以得出的结论是 。
(7)设计实验2、3的目的是 。
(14分)I、某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为
II、一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com