
题目列表(包括答案和解析)
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
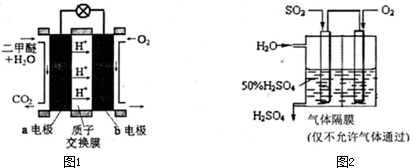
[化学-物质结构与性质]
Ⅰ、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1 mol CH4生成,则有________mol σ键和________mol π键断裂.
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为________.
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有________(填字母代号)
a、离子键
b、共价键
c、配位键
d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于________(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=________.
Ⅲ.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl42-比HgI42-更________(填“稳定”或“不稳定”),因为________.
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第 周期,第 族。
(3)能用于比较N与O非金属性相对强弱的事实是 。
A.最高价氧化物对应水化物的酸性 B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度 D.NO中氮元素显正价,氧元素显负价
(4)写出生成物中含极性键的非极性分子的电子式为 。
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式 为: 。
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第 周期,第 族。
(3)能用于比较N与O非金属性相对强弱的事实是 。
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com