
题目列表(包括答案和解析)
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
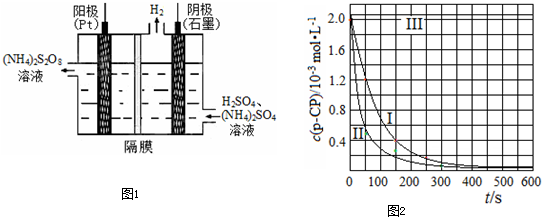
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
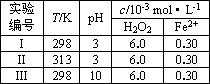
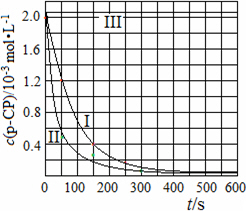
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
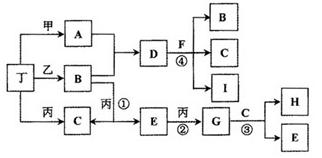
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol •L-1 B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol • L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol • L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。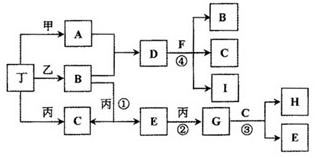
请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol? L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol ? L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com