
题目列表(包括答案和解析)
| (2013?丰台区二模)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:( ) CO(g)+2H2(g)?CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
|
甲醇物 时间 质的量 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| 500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
 N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。 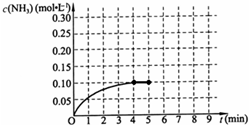 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com