
题目列表(包括答案和解析)
(1)消石灰在氯化时总不能完全彻底的原因是_______________________________________。
(2)得出“漂白粉是一种有特殊组成的不同于一般混合物”这一结论的理由是_____________________________________________________________________。
(3)认为化学式“Ca(ClO)2·CaCl2·xCa(OH)2·yH2O”更能准确表示漂白粉组成的理由是____________________________________________________________________。
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 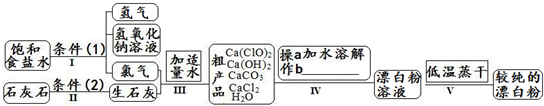 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
洪灾过后,饮用水的消毒杀菌成为抑制传染性疾病大规模爆发的有效方法之一.漂白粉是常用的消毒剂. (1)工业上将氯气通入石灰乳制取漂白粉.请写出下反应的化学方程式为: ①实验室制备氯气 MnO2+4HCl
MnO2+4HCl ;
②工业制备氯气 2NaCl+2H2O
2NaCl+2H2O ;
③工业制备漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O .(2)漂白粉的水溶液与空气接触后才能体现漂白、杀菌作用,能说明其原理的化学方程式是 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO .(3)已知二氧化硫和亚硫酸盐具有较强的还原性,亚硫酸的酸性比次氯酸的酸性强.若将少量的SO2通入漂白粉溶液中,有同学认为发生的反应为:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO.你认为该同学的说法是否正确? 不正确 不正确 (填“正确”或“不正确”)请说明理由二氧化硫具有较强的还原性与具有强氧化性的次氯酸钙接触时将发生氧化还原反应 二氧化硫具有较强的还原性与具有强氧化性的次氯酸钙接触时将发生氧化还原反应 .瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:  (1)A仪器的名称是 分液漏斗 分液漏斗 ,所盛试剂是浓盐酸 浓盐酸 ,B中发生反应的化学方程式是MnO2+4HCl(浓)
MnO2+4HCl(浓) .
(2)漂白粉将在U形管中产生,其化学方程式是 2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O 2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O .(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 将U形管置于冷水浴中 将U形管置于冷水浴中 .②试判断另一个副反应(写出此反应方程式): 2HCl+Ca(OH)2=CaCl2+2H2O 2HCl+Ca(OH)2=CaCl2+2H2O .为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置 在B、C之间增加一个饱和食盐水洗气装置 .(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1 mol Cl2,转移电子的物质的量为 1 1 mol,被氧化的HCl的物质的量为1 1 mol.有效氯是漂粉精中有效Ca(ClO)2 的含量大小的标志.已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)×100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为65.5% 65.5% (保留一位小数).某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。 (2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。 (3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化; b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。 ① 实验a的目的是______________________________________________________。 ②由实验a、b不能判断白雾中含有HCl,理由是________________________________。 (4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。 (5)将A瓶中混合物过滤、洗涤,得到沉淀X ①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。 ②用离子方程式解释现象iii中黄绿色褪去的原因:_____________________________________________________________________。
同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |