
题目列表(包括答案和解析)
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。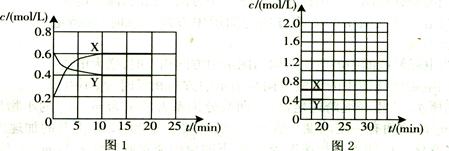
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
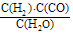 ,它所对应反应的化学方程式为_______________________。
,它所对应反应的化学方程式为_______________________。  CH3OH(g) △H1=-90.7kJ/mol
CH3OH(g) △H1=-90.7kJ/mol CH3OCH3(g) +H2O(g) △H2=-23.5kJ/mol
CH3OCH3(g) +H2O(g) △H2=-23.5kJ/mol CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol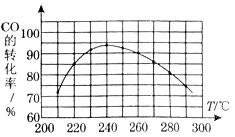
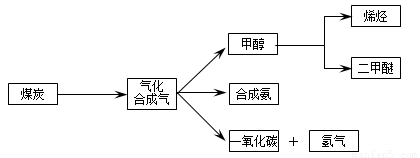
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
I.已知该产业链中某反应的平衡表达式为:K=![]() ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。 830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是 ,其原因是 .
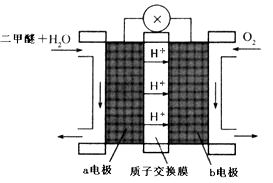
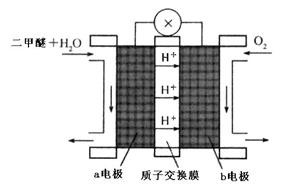
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式 。
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: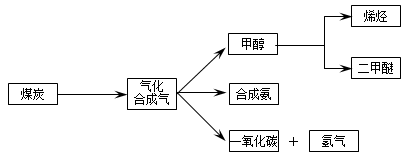
I.已知该产业链中某反应的平衡表达式为:K=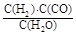 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa, 温度230~280℃)进行下列反应:
温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是 ,其原因是 .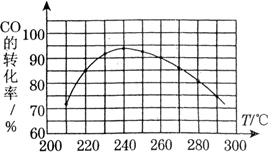
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式  。
。
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
I.已知该产业链中某反应的平衡表达式为:K=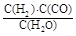 ,它所对应反应的化学方程式为
。
,它所对应反应的化学方程式为
。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。 830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是 ,其原因是 .
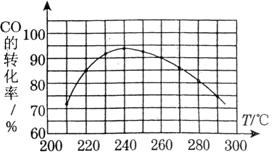
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com