
题目列表(包括答案和解析)
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以
恢复到电解前的物质的浓度
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:

阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2molNaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
(12分)电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水 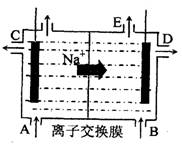 原理示意图。电极反应为:
原理示意图。电极反应为:
阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
|
| A.从E口逸出的气体是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,便产生2mol NaOH |
| D.向电解后的阴极溶液中加适量盐酸,可以 |
| ||
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com