
题目列表(包括答案和解析)
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______________。
(2)写出Y的电子式: ______。用电子式表示Z的形成过程:____________________
_____________________________________________________________________。
(3)写出丁的最高价氧化物的水化物与丙的最高价氧化物的水化物反应的离子方程式:___________ __________________________________________________________。
(4)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
考查知识点:由原子结构、元素及其化合物的性质推测性质。离子的结构示意图,电子式的书写,以及用电子式表示共价化合物的形成过程。氧化还原反应中,利用电子守恒的计算。
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______________。
(2)写出Y的电子式: ______。用电子式表示Z的形成过程:____________________
_____________________________________________________________________。
(3)写出丁的最高价氧化物的水化物与丙的最高价氧化物的水化物反应的离子方程式:___________ __________________________________________________________。
(4)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
考查知识点:由原子结构、元素及其化合物的性质推测性质。离子的结构示意图,电子式的书写,以及用电子式表示共价化合物的形成过程。氧化还原反应中,利用电子守恒的计算。
单质硼有无定形和晶体硼两种,图为晶体硼结构示意图.参考下列数据
晶体 金刚石 晶体硅 晶体硼
熔点(K) 73832 1683 2573
沸点(K) 5100 2628 3823
硬度 10 7.0 9.6
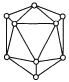
(1)晶体硼属于________晶体,理由是________.
(2)晶体硼的基本结构单元是由硼原子组成的正二十面体,其中含有20个等边三角形,且每个顶点各有一个硼原子.这个基本结构单元由________个硼原子构成,键角是________,共有________个B![]() B键.
B键.
A、B、C、D、E是周期表中短周期元素,它们的原子序数依次增大,A和D的最外层电子数是其电子层数的2倍,B和D同主族,C的原子是短周期元素中原子半径最大的。请回答:
(1)写出元素名称:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,
该分子是 (填“极性”或“非极性”)分子。
(3)常温下将E单质通入到C的最高价氧化物对应的水化物溶液里发生反应的离子方程
式为 。
(4)请写出B和C按原子个数比1∶1形成的化合物与A和B按按原子个数比1∶2形成的化合物反应的化学方程式,并标出电子转移的方向和数目 。
②(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
| Z | |||||||||||||||||
| M | L | Q | R | ||||||||||||||
| D | A | T | X | Y | |||||||||||||
| E | J | ||||||||||||||||
(1)Y分别与D、E形成的化合物中熔点较高是_________(用具体物质的化学式表示)。
(2)LY4分子的电子式是_____ ____。高#考¥ 资@源 网
 (3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。J(LR)4固态时属于_________晶体(填晶体类型)。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。J(LR)4固态时属于_________晶体(填晶体类型)。
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度
的最高记录。右图中所示的是该化合物的晶体结构单元。图中
上、下底面中心“Δ”处的原子是_______(填元素符号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com