
题目列表(包括答案和解析)
近期,我国个别企业违法排污导致地下
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:

③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: ,
,
消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为 mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____ (填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
A.没有用蒸馏水洗涤烧杯
B.定容时俯视容量瓶刻度线
C.配制前容量瓶洗净后没干燥
D.摇匀后见液面下降,再加水至刻度线
E.用天平称量药品时,左盘低,右盘高
(2013?江西模拟)某溶液中,只可能含有下列离子中的几种:现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g.下列说法错误的是( )
|
某溶液中,只可能含有下列离子中的几种:
|
阳离子 |
K+、Mg2、Fe3+、Al3+ |
|
阴离子 |
|
现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。下列说法错误的是( )
A.C( )=0.2 mol/L B.C(K+)一定为0.6mol/L
)=0.2 mol/L B.C(K+)一定为0.6mol/L
C.氯离子可能存在 D.一定有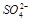 和
和
(16分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为

 。
。
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是_ __,图示装置中缺少的一种必须的玻璃仪器是_____________。

②装置A用于溶解产生的二氧化氯气体,其中最好盛放_______(填字母)。
a.20mL 60℃的温水 b.100mL冰水
c.100mL饱和食盐水 d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为______________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。饮用水中ClO2、
)。饮用水中ClO2、 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是____________________________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为_________________
_____________。
以测定其含量,该反应的离子方程式为_________________
_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com