
题目列表(包括答案和解析)
5.( )已知纳米材料是指粒子直径在1~100nm的材料。美国IBM 制造出了第一批纳米碳管晶体管,发明了利用电子的波性为传递信息的“导线”。下列有关纳米碳管的说法正确的是
A、纳米碳管是一种新型的高分子化合物 B、纳米碳管的化学性质活泼
C、纳米碳管导电属于化学变化
D、纳米碳管、金刚石、石墨、C60的构成相同
4.( )下列叙述不适合用质量守恒定律解释的是
A.水加热变成水蒸气,变化前后质量相等
B.要得到18g水,则参加反应的氢气和氧气的总质量一定为18g
C.1g硫与1g氧气化合生成2g二氧化硫
D.在置换反应中,参加反应的单质的质量不一定等于生成的单质质量
3.天文学家观察到“百武”彗星因受到越来越强的阳光照射而产生喷气现象。喷出气体包括:CO、CH3OH(甲醇)、HCHO(甲醛)、HCN(氢氰酸)等有毒物质和水蒸气。根据这一信息可以推测:
A.“百武”彗星至少含有C、H、N、O元素
B.“百武”彗星中存在单质和化合物
C.“百武”彗星是一个液态混合物
D.“百武”彗星可能存在生命
2.( )实验室中装有浓硫酸的试剂瓶应贴有的图标是

A B C D
1.( ) 下列都是生活中常见的物质,其中属于纯净物的是
A.黄酒 B.冰水 C.碘盐 D.食醋
30. (7分) 某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/g |
5 |
10 |
15 |
20 |
|
生成CO2的质量/g |
1.54 |
3.08 |
4.4 |
m |
⑴哪几项反应中盐酸有剩余______________;⑵ m= __________________;
⑶试计算这种石灰石矿中碳酸钙的质量分数。
31 (6分)中国是一个人口众多的发展中国家,人们注意到:西方国家的发展模式不完全适用于中国,例如:
(1)设想中国每家都有轿车,则每天需供应8000万桶石油(目前全世界每天的产油量约为6700万桶),如果每7桶石油为1吨,每吨石油能提炼出70%(质量分数)的燃料油,以燃料油中平均含C、H原子比例为10∶22(燃烧产物为二氧化碳、水)计算,到那时,中国由于轿车燃油将可能每天排放温室气体多少万吨?
(2)设想以植物性食物为主的中国人,平均食用牛肉的水平若与美国人相当,则每年需增加粮食3.4亿吨(这相当于美国一年的粮食产量),如果每吨粮食生产需提供0.1吨氮元素,则:
①中国每年将需要多供应多少吨尿素[CO(NH2)2]?
②尿素生产原理为: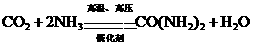 ,据此计算:为增产尿素,需再建年产20万吨合成氨的工厂几座?
,据此计算:为增产尿素,需再建年产20万吨合成氨的工厂几座?
29. (11分)比较与归纳,是我们学习化学的常用方法。请结合下列实验常用装置,回答有关问题。
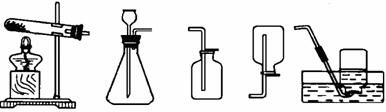
A B C D E
(1)用A和E组合装置制取氧气,发生反应的化学方程式为________________________________________________,
将药品加入装置A中的试管前,应进行的操作是______________________________________。
(2)实验室制取二氧化碳气体应选用的发生装置和收集装置分别为_____________,用该发生装置制取气体应满足的一般条件是 。实验室制取大量CO2气体,是否能用稀硫酸和大理石为原料? (填“是”或“否”)为什么? 。
甲图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应;关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停上反应。用该装置制备CO2可起到节约药品和取用方便的效果。A、B、C、D装置中哪些可以起到与甲图装置相同的效果? (填写编号)。

(3)若用A装置进行木炭还原氧化铜实验并检验气体产物,还需补充部分装置。补充装置中所需的仪器是______________________________,所需的化学药品为 。发生反应的化学方程式为___________________________,_________________________________。
27.(3分)下列实验技能都是你必须具备的,你能作出正确回答吗?
⑴如何判断玻璃仪器已经洗涤干净?
。
⑵加热氯酸钾制氧气,用排水法收集,何时开始?
。
⑶洒出的酒精在桌上燃烧起来,如何处理?
。
25.(3分)在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如: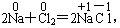 反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。
反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析下列反应属于氧化还原反应的是(填序号) 。
A.2Mg+O2 2MgO B.CaO+H2O=Ca(OH)2
C.2KClO3
2MgO B.CaO+H2O=Ca(OH)2
C.2KClO3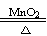 2KCl+3O2↑ D.CaCO3
2KCl+3O2↑ D.CaCO3 CaO+CO2↑
E.H2+CuO
CaO+CO2↑
E.H2+CuO Cu+H2O F.HCl+NaOH=NaCl+H2O (2)根据上面的分析推理,对下列两种基本反应类型是否属于氧化还原反应,作出恰当的概括。
化合反应: 。
分解反应: 。
26.(4分)(9分)一氧化氮是大气的主要污染物之一。近几年来,又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。
Cu+H2O F.HCl+NaOH=NaCl+H2O (2)根据上面的分析推理,对下列两种基本反应类型是否属于氧化还原反应,作出恰当的概括。
化合反应: 。
分解反应: 。
26.(4分)(9分)一氧化氮是大气的主要污染物之一。近几年来,又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。
|
4X+5O2  4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
⑵汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理的方法是在汽车尾气的排风管上装一个催化转换器,在催化剂的作用下,一氧化氮与一氧化碳反应可生成二氧化碳和氮气,该反应的化学方程式为: 。
⑶某同学希望了解尾气中一氧化碳的含量,于是在环保科研人员的帮助下,采集了一定量的汽车尾气,并把它转化为二氧化碳和氮气。下面该同学该怎样将二氧化碳和氮气分开呢?并设法计算出一氧化碳的含量 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com