
题目列表(包括答案和解析)
6.(福州市2002年中考试题)有一包固体粉末,是由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成的,通过实验得到以下结果:
(1) 将此固体粉末加到水中,得到白色沉淀,上层溶液为无色;
(2) 该白色粉末能全部溶解在稀硝酸中。
从实验可以判断,该固体粉末中一定不含有 ,它的组成可能是: 。
5.(南通市2002年化学中考试题)下列各组物质的溶液,不加其他试剂就可以鉴别的是 ( )
(a) Na2CO3 H2SO4 HCl NaOH
(b) NaCl MgCl2 FeCl3 NaOH
(c) AgNO3 Na2CO3 NaCl HNO3
(d) Na2CO3 K2CO3 KCl HNO3
4.我市某学校化学兴趣小组的一次调查报告如下:
调查对象:群利化工厂排放的废水。
目测结果:样品略呈蓝色,无悬浮颗粒,透明。
实验过程:
取少量样品,加入过量的盐酸,有白色沉淀生成。过滤,在沉淀物里加入稀硝酸,沉淀不溶解。
将所得滤液分为两份,一份滤液里加入适量的稀硫酸,产生白色沉淀,过滤,在沉淀物里加入稀硝酸,沉淀不溶解。
向另一份滤液里加入过量的氢氧化钠溶液,只产生蓝色沉淀。
实验结果:废水里含有的大量阴离子是 ,
肯定含有的阳离子是 。
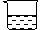
3.如右图所示,在一只倒扣的大烧杯中,正放两只小烧杯。其中A杯内盛放了某种浓溶液,B杯中盛有少量滴加了紫色石蕊试液的水。请问:
(1) 假如B杯内石蕊试液变为红色,A杯内可能盛放的浓溶液是
 (2) 假如B杯内石蕊试液变为蓝色,A杯内可能盛放的浓溶液是
(2) 假如B杯内石蕊试液变为蓝色,A杯内可能盛放的浓溶液是
 A B
A B
例题5-1:一种固体混合物,其中可能含有氯化钙、碳酸钠、硫酸铜、硫酸钠、硝酸钡和硝酸钾中的一种或几种。现进行如下实验:
(1)将固体混合物放入足量的水里,充分搅拌后得到无色透明溶液和白色沉淀;(2)再加入足量的稀硝酸,沉淀全部溶解,产生无色气体,溶液澄清透明;(3)最后加入稀硫酸,又出现了白色沉淀。
请根据以上实验事实推断:原混合物中肯定存在 ,肯定不存在 ,可能存在 。
分析:物质推断题的特点是必须在熟悉各种物质性质的基础上,对实验事实进行仔细的分析,寻找关键的字句,从而得出适当的结论。
在本题中,从实验事实(1)所说的得到无色透明溶液可以看出,一定不存在硫酸铜。生成的白色沉淀从事实(2)知道可以溶解于硝酸,所以可能是碳酸钙或碳酸钡,不可能是硫酸钡,所以肯定存在碳酸钠,一定没有硫酸钠。从事实(3)知道在有硝酸存在的情况下加入稀硫酸产生白色沉淀,这个沉淀只能是硫酸钡,所以一定存在硝酸钡。至于氯化钙和硝酸钾是否存在,就没有实验事实可以说明了,应该属于不能确定是否存在的物质了。
结论:原混合物中肯定存在碳酸钠、硝酸钡;肯定不存在硫酸铜、硫酸钠;可能存在氯化钙和硝酸钾。
例题5-2:某碳酸钾样品中含有碳酸钠、硝酸钾和硝酸钡三种杂质里的一种或两种。现将13.8克样品加入足量的水,样品全部溶解。再加入过量的氯化钙溶液,得到9克沉淀。请计算回答:样品中一定有的杂质是 ,一定没有的杂质是 。
分析:本题是一个和计算结合的物质推断题。做这一类题目我们首先要计算假如样品纯净的话可以得到多少沉淀,然后考虑杂质使得沉淀增加了还是减少了。再根据杂质与加入的试剂反应后产生的沉淀质量大小确定其影响,进一步做出正确的推论。在这一个题目里,我们可以算出假如13.8克全部是碳酸钾,和氯化钙反应后应该生成10克沉淀,由此可见,杂质的加入使沉淀质量减少了。而相同质量的碳酸钠与氯化钙反应生成的沉淀大于10克;硝酸钾和氯化钙不生成沉淀(也是一种减少)。因为实验告诉我们,样品加入水里以后,全部溶解,这说明不含硝酸钡(硝酸钡和碳酸钾可以生成碳酸钡沉淀)。现在是含了杂质以后,沉淀质量减少了,所以肯定含有硝酸钾(也可能含有碳酸钠,因为只要质量不是很多,其影响也可以被硝酸钾抵消)。
结论:一定有的杂质是硝酸钾;一定没有的杂质是硝酸钡。
拓展练习题:
1.(2002年天津市中考试题)乙醇是以高梁、玉米、薯类等为原料,经发酵、蒸馏而制得,属于可再生能源。在汽油中加入适量的乙醇作为汽油燃料,可节省石油资源,减少汽车尾气的污染。2001年4月2日国家技术监督局发布《车用乙醇汽油》国家标准,并于同年4月15日开始实施。
乙醇(C2H5OH)完全燃烧时生成CO2和H2O。如果氧气不充分,乙醇燃烧后可能还有CO生成。现用以下装置进行实验,确证乙醇燃烧产物中有CO、CO2和H2O。
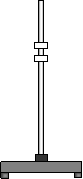



 乙醇燃烧产物
玻璃管内有氧化铜
乙醇燃烧产物
玻璃管内有氧化铜
→




无水硫酸铜

石灰水 烧碱溶液 石灰水
石灰水
A B C D E F
请回答下列问题:
(1) 能确证产物中有水的现象是 ;能确证产物中有一氧化碳的现象是 。
(2) 实验时,可以观察到装置B中石灰水变浑浊,D中石灰水无变化。
B装置的作用是 ;
C装置的作用是 ;
D装置的作用是 。
(3) 若乙醇燃烧产物中一氧化碳和二氧化碳的质量之和是25.2g,其中碳、氧元素质量比为2︰5,则参加反应的乙醇质量为 g,产物中水的质量是 g。
(4) 科学家发现海底蕴藏着大量的“可燃冰”――甲烷的水合物。质量相等的甲烷和乙醇在氧气充足的条件下完全燃烧,产生二氧化碳质量较多的是 。
2 (2002年扬州市中考试题)请根据图示来推断物质(假设反应均完全进行):



|








|
|
|


|
|
|
|
加氢氧化钠溶液
充分搅拌 加C溶液
过滤
加稀硝酸
请用化学式回答:
(1) E是 ,D是 ;
(2) F可能是(只要写出一种) ,此时与F对应的C是 ;
(3) A是 或 ;B 或 。
有一类物质鉴别题,要求不使用其他任何试剂鉴别多种物质。对于这一类题目,我们可以从以下几种方法入手:
(1)察颜观色法:首先通过观察找出有特征颜色的溶液,如蓝色的可溶性铜盐溶液,棕黄色的铁盐溶液,浅绿色的亚铁盐溶液。然后以这些溶液为试剂,进一步检验其他溶液的方法。
例如,要不用任何试剂鉴别硝酸铵、氯化镁、氯化铁、氢氧化钠、硝酸钾五种溶液。可以首先观察出显示棕黄色的氯化铁溶液,然后把氯化铁溶液分别加到另外四种溶液里去,产生红褐色沉淀的是氢氧化钠溶液,再把氢氧化钠溶液分别加到另外三种溶液里,有白色沉淀的是氯化镁溶液,有刺激性气味气体生成的是硝酸铵溶液,没有任何现象的是硝酸钾溶液。
(2)两两混合法:我们经常遇到这样一种问题,那就是判断所给予的一组物质能不能不用任何试剂进行鉴别。对于这样的题目,我们可以采用两两混合列表比较的方法进行分析。例如,能不能不用任何试剂鉴别氯化钡、碳酸钠、硝酸银和盐酸呢?先把四种物质进行两两混合实验的结果列表如下:
|
|
BaCl2 |
Na2CO3 |
AgNO3 |
HCl |
|
BaCl2 |
|
↓ |
|
- |
|
Na2CO3 |
↓ |
|
↓ |
↑ |
|
AgNO3 |
↓ |
↓ |
|
↓ |
|
HCl |
- |
↑ |
↓ |
|
这样,我们就可以看出,四种物质的反应现象是各不相同的,可以不使用任何试剂进行鉴别。而且,我们还可以知道,能跟其他三种物质都生成沉淀的是硝酸银溶液;能跟两种物质生成沉淀而跟一种物质生成气体的是碳酸钠;能跟两种物质生成沉淀而跟另一种物质没有反应现象的是氯化钡溶液;和一种物质生成沉淀,一种生成气体,一种没有现象的是盐酸。而如果把氯化钡换成氯化钾或者氯化钠,那就不能不用任何试剂鉴别了,因为那样的话,碳酸钠和盐酸就都是和一种物质反应生成沉淀,和一种物质反应生成气体了,无法区分两者了。
(3)嗅闻气味法:有些物质具有特殊的气味,如氨水。我们可以通过嗅闻气味识别出来,然后再用它去鉴别其他物质。
例题 3-1:有盐酸、氯化铵、硫酸镁和无色酚酞四种无色溶液,如果仅用一种试剂就可以区分它们,下列可以选用的试剂是
(A) AgNO3 (B) BaCl2 (C) NaOH (D) 稀H2SO4
分析:用一种试剂鉴别多种物质要根据所鉴别的物质组成情况选择适当的试剂
(1) 如果被鉴别的物质有明显的酸碱性差别,可以选用指示剂或PH试纸鉴别。例如,盐酸、碳酸钠和硝酸钾溶液可以选用紫色石蕊试液或者PH试纸加以鉴别。
(2) 如果被鉴别的物质溶解性明显不同,以及溶解时有明显的热现象,可以选择水作为检验试剂。例如,要鉴别硝酸铵、氯化钠、碳酸钙、氢氧化钠四种固体,可以选用水。硝酸铵溶解于水的时候溶液温度明显下降;氯化钠溶解于水的时候溶液温度基本不变;碳酸钙不溶解于水;氢氧化钠溶解于水的时候溶液温度明显升高。
(3) 如果被鉴别的物质存在相同的阴离子或大多数相同的阴离子,可以考虑选用强碱溶液来检验。例如,要鉴别氯化铁、硫酸铜、氯化镁、氯化钠和氯化铵溶液,可以选用氢氧化钠溶液。氯化铁溶液和氢氧化钠溶液反应后生成红褐色沉淀;硫酸铜溶液和氢氧化钠溶液反应后生成蓝色沉淀;氯化镁溶液和氢氧化钠溶液反应后生成白色沉淀;氯化钠和氢氧化钠不反应;氯化铵溶液和氢氧化钠溶液反应后产生有刺激性气味的气体。
(4) 如果被鉴别的物质存在相同或大多数相同的金属阳离子,可以选择强酸溶液来检验。例如,要鉴别碳酸钠、氯化钠、亚硫酸钠溶液,选用盐酸或稀硫酸就可以了。碳酸钠和酸反应产生无色无味的气体;氯化钠和酸不反应;亚硫酸钠溶液和酸反应产生有刺激性气味的气体。
(5) 如果被鉴别的物质是金属单质和金属氧化物,可以选择强酸鉴别。例如,要鉴别炭粉、氧化铜粉末、铜粉和氧化铁粉末,选用稀硫酸或者盐酸就可以。炭粉是黑色的,不溶解于酸;氧化铜也是黑色的,但是溶解于酸;铜粉和氧化铁粉末都是红色的,但是氧化铁可以溶解于酸,而铜粉不溶解于酸。
(6) 如果被鉴别的物质组成情况比较复杂,就要考虑选用含有可以区分不同的阳离子需要什么离子,区分不同阴离子需要什么离子,然后把这两种离子组合成为一种试剂。例如,要鉴别氯化铵、硫酸铵、氯化钠、硫酸钠四种无色溶液,考虑到鉴别銨根离子和钠离子可以选用氢氧根离子,鉴别氯离子和硫酸根离子可以选用钡离子,结合起来就可以选择氢氧化钡溶液作为鉴别使用的试剂。
本题分析:我们现在要鉴别的是盐酸、氯化铵、硫酸镁和无色酚酞四种无色溶液,考虑到酚酞是指示剂,应该选择酸或者碱溶液,而碱溶液又可以鉴别銨根和镁离子,所以可以选择氢氧化钠溶液。盐酸没有明显的反应现象;氯化铵遇到氢氧化钠生成刺激性气味的氨气;硫酸镁和氢氧化钠溶液反应生成白色沉淀;酚酞遇到氢氧化钠会变红色。
例题2-1:某同学在实验室做了如下实验:取一药匙氧化钙放入一个洁净的烧杯里,加适量水,用玻璃棒搅拌,然后放置澄清。
(1) 请问可以选用什么试剂来确定上层清液显碱性;
(2) 请你设计一个简单的实验方案,鉴定上层清液里的溶质是氢氧化钙。
分析:实验鉴定题的特点是既要检验其中的阳离子,也要检验其中的阴离子,这样才能确定需要鉴定的物质。
题解:要确定一个溶液显碱性,可以选择的试剂很多,例如石蕊试液、酚酞试液、PH试纸、氯化铁溶液、硫酸铜溶液等等都可以。要鉴定无色清液里的溶质是氢氧化钙,我们可以在证明清液显碱性的基础上进一步证明其中含有钙离子,这可以选用少量可溶性碳酸盐溶液加进去,看到出现白色沉淀即可以证明其中含有钙离子,由此可以证明上层清液的溶质是氢氧化钙。
要解好物质的检验题,必须依靠我们对于物质性质及常见物质的检验方法的了解。所以我们先介绍一些基本的检验方法。
常见气体的检验
|
气体 |
检验方法 |
现象 |
|
氧气 |
将带火星的木条插入有关容器内 |
木条复燃 |
|
氢气 |
点燃,在火焰上方罩一个冷而干燥的小烧杯 |
发出淡蓝色火焰,烧杯壁上有水珠凝结 |
|
依次通过灼热的氧化铜和白色的无水硫酸铜 |
黑色氧化铜变红,白色硫酸铜变蓝 |
|
|
二氧化碳 |
通入澄清石灰水中 |
澄清的石灰水变浑浊 |
|
一氧化碳 |
点燃,在火焰上方罩一个冷而干燥的小烧杯,再向烧杯内倒入澄清石灰水,振荡 |
发出淡蓝色火焰,烧杯壁上没有水珠凝结,石灰水变浑浊 |
|
依次通过灼热的氧化铜和澄清石灰水 |
黑色氧化铜变红,澄清的石灰水变浑浊 |
|
|
甲烷 |
点燃,在火焰上方罩一个冷而干燥的小烧杯,再向烧杯内倒入澄清石灰水,振荡 |
发出蓝色火焰,烧杯壁上有水珠凝结,石灰水变浑浊 |
|
氮气 |
将点燃的木条插入有关容器内,再倒入澄清石灰水,振荡 |
木条马上熄灭,石灰水不变浑浊 |
|
氯化氢 |
将湿润的蓝色石蕊试纸放在瓶口 |
蓝色石蕊试纸变红 |
|
通入水里,滴入硝酸银溶液和稀硝酸 |
生成不溶解于稀硝酸的白色沉淀 |
|
|
水蒸气 |
通过白色的无水硫酸铜 |
白色无水硫酸铜变蓝 |
常见物质(离子)的检验方法
|
物质 |
使用试剂 |
现象 |
||
|
酸(H+) |
(1)紫色石蕊试液 (2)PH试纸 (3)加入锌粒或镁条 |
变红 PH<7 产生可燃性气体 |
||
|
碱(OH-) |
(1) 紫色石蕊试液 (2) PH试纸 (3) 无色酚酞试液 |
变蓝 PH>7 变红 |
||
|
盐酸或可溶解的盐酸盐 |
硝酸银溶液和稀硝酸 |
生成白色沉淀,沉淀不溶于稀硝酸 |
||
|
硫酸或可溶解的硫酸盐 |
氯化钡溶液和稀硝酸 |
生成白色沉淀,沉淀不溶于稀硝酸 (但是要注意溶液里是否有银离子) |
||
|
碳酸盐 |
盐酸和澄清石灰水 |
产生气体,气体能使澄清石灰水变浑浊 |
||
|
可溶性铜盐 |
氢氧化钠溶液 |
生成蓝色氢氧化铜沉淀 |
||
|
可溶性铁盐 |
氢氧化钠溶液 |
生成红褐色氢氧化铁沉淀 |
||
|
铵盐 |
氢氧化钠溶液,湿润的红色石蕊试纸或无色酚酞试纸 ,加热 |
产生刺激性气味的气体,能使石蕊试纸变蓝或无色酚酞试纸变红 |
||
|
|
|
|
||
24.增大;把船的空心部分做得更大(或在水中加盐)25.(1)(移动磁铁)将磁铁的B部位(或磁铁长边)与纸线对齐,将曲别针逐渐向B部位移近,至被吸动为止,记下曲别针距磁铁B部位的行数(2)
|
磁铁(被测)部位 |
|
磁性强度/行 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com