
题目列表(包括答案和解析)
6.在下列分子中,存在手性碳原子的是
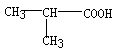
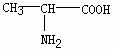 A.
B.
A.
B.
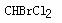 C.
C. 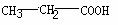 D.
D.
5. 在下面的电子结构中,第一电离能最小的原子可能是
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
4. 下列关于乙烯和聚乙烯的叙述不正确的是
A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物
B.乙烯的化学性质比聚乙烯活泼
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.乙烯和聚乙烯都能使溴水褪色
3.共价键、离子键和范德华力都是微粒之间的不同作用力,下列晶体中同时含有上述两种结合力的是
① Na2O2 ② SiO2 ③ 石墨 ④ 金刚石 ⑤ NaCl ⑥ C60
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
2.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
1.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
22、87.75g食盐与18mol/L的浓硫酸55.5mL混合微热后能生成HCl气体多少mol?在加热到600℃反应后生成多少mol的HCl气体?若将两次生成的HCl用219g水吸收,生成密度为1. 098g/L,求盐酸的物质的量浓度?
第二学期期中考试
21、取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr的水溶液中,经加热蒸发水分并烘干后,得质量为13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2多少克?
(3)软锰矿含MnO2的质量分数。
20、实验室用下列仪器和药品制取干燥纯净的氯气。
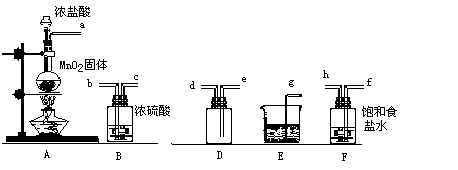
(1)、按气流从左到右,装置正确的连接( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
(2)装置F的作用是 ,
装置E的作用是 。
(3)装置A和E中的反应化学方程式为
A 。
E 。
(4):若A中有4.48L氯气产生(标准状态下),则被氧化的HCl有 g。
19、有一包白色固体可能是NaCl、NaI、CuSO4、Na2SO4中的一种或几种物质组成,取上述少量固体,溶于水得无色溶液,并进行如下实验:
(1)在上述溶液中加入足量的氯水,溶液变棕黄色,再加入少量汽油,振荡,静置,油层呈紫红色;
(2)对(1)中所得液体进行分液处理,取水层并加入适量的AgNO3溶液,有白色沉淀生成,再加过量的稀硝酸沉淀不溶解;
(3)过滤上述混合物,在滤液中加Ba (NO3)2溶液,没有沉淀产生。
试判断,原混合物中一定存在的物质是 ,肯定不存在的物质是 , 可能存在的物质是 . (均用化学式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com