
题目列表(包括答案和解析)
2、已建立平衡的某可逆反应,当改变条件使化学平衡向正反应移动时,下列叙述正确的是: ①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增加;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥使用了合适的催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
1、对于反应2SO2+O2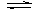 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A、2体积SO2与足量O2反应,必定生成2体积SO3 B、其它条件不变,增大压强,平衡必定向右移动
C、平衡时,SO2消耗速率必定等于O2生成速率的两倍 D、平衡时,SO2浓度必定等于O2浓度的两倍
46.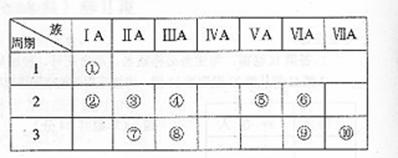 右表是元素周期表的一部分。
右表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
1C 2 A 3 C 4 B 5 C 6 D 7 B 8 A 9 C 10 C
11 A 12 B 13C 14 AB 15 C 16A 17D 18D 19C 20D
21BD 22A 23D 24B 25D 26B 27A 28B 29A 30B
31D 32 C 33D 34D 35 B 36 A 37D 38C 39D
40 (1)<1>H2 <2>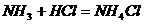
(2)<1>SO2
<2>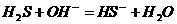
<3>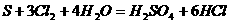
41 (共9分)(1)NH3;H2、CO2、Cl2(共4分,每种气体1分)(2)分液漏斗 圆底烧瓶
(共2分,每空1分)(3)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(2分)a(1分)
42 (共5分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
1mol 22.4L
n(CuSO4) 22.4L
1mol:n(CuSO4)=22.4L:2.24L
n(CuSO4)=0.1mol (2分)
(2)c(CuSO4)=0.1mol/0.5L=0.2mol/L (1分)
43 (10分) ⑴100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
⑵溶解 过滤 (3)BaCl2[或Ba(OH)2]、K2CO3、HCl
44 (12分)(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
45 (6分)(1)N2 CO; CO2 N2O (2)SO2、 O3
46 (1)HCl 弱 (2)N (3)H、O、S
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O Li
45. (6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
44.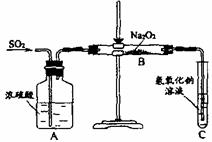 (12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:







上述方案是否合理? 。请简要说明两点理由:
① ;② 。
43. (10分)请按要求填空:(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式): 。
42. (5分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:(1)反应后生成硫酸铜的物质的量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
41.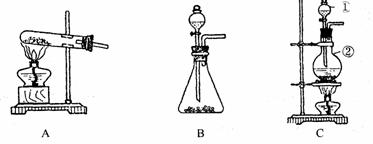 (9分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
(9分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
(1)选用A装置可制取的气体有________________选用B装置可制取的气体有________________通常选用C装置制取的气体有______
(2)标号①、②的仪器名称依次为_______ ,________________
(3)写出利用上述有关药品制取氨气的化学方程式: ______________
若要制得干燥的氨气,可选用下列干燥剂中的________________(填序号)
a.生石灰 b,浓硫酸 C.三五氧化二磷
40.(15分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应: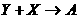 (气),
(气), (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是__________________________;
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是______________。
39. 20℃时,饱和KCl溶液的密度为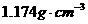 ,物质的量浓度为
,物质的量浓度为 ,则下列说法中不正确的是A. 25℃时,饱和KCl溶液的浓度大于
,则下列说法中不正确的是A. 25℃时,饱和KCl溶液的浓度大于 B. 此溶液中KCl的质量分数为
B. 此溶液中KCl的质量分数为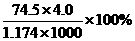 C. 20℃时,密度小于
C. 20℃时,密度小于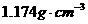 的KCl溶液是不饱和溶液 D. 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于
的KCl溶液是不饱和溶液 D. 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于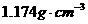
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com