
题目列表(包括答案和解析)
3.下列物质在自然界中存在的有( )
A.KNO3 B.KOH C.K2O2 D.K
2.下列比较不正确的是( )
A.熔点:Li>Na>K B.碱性:LiOH<NaOH<KOH
C.还原性:K>Na>Li D.氧化性:Cs+>Rb+>K+
1.跟水反应最剧烈的碱金属是( )
A.Li B.Na C.K D.Rb
4.0g 5.0g 4.0g 5.0g
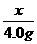 =
=
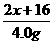 =
=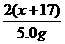
x=68 x=28
因为混合物为金属和氧化物组成,故金属的相对原子质量应介于28-68之间,在此区间内的碱金属只有钾.
故,该碱金属元素为钾.
例6 现有A、B、C、D四种化合物,透过蓝色钴玻璃其焰色反应均为紫色,A、B、C和盐酸发生反应后,均得到D;将固体C加热可得到A;若在A的溶液中通入一种无色无味气体,可制得C,若B与C的溶液混合可制得A;推断:A为 ;B为 ;C为 ;D为 .写出有关反应的化学方程式: .
解析:解该题的突破口在A、B、C均可与盐酸发生反应,证明A、B、C可能是KOH或K的弱酸盐,而下一步展开,C加热可分解,进一步证明C是KHCO3,A溶液中通入无色无味气体得C,进一步证明C是KHCO3,而A为K2CO3.这样可知D为KCl.
因此解此类推断题重要的是找准突破口,突破口一找到,其他问题则会迎刃而解.
另外,本题第一已知条件:“其焰色反应均为紫色”也很重要,据此,我们首先可断定这四种化合物含有钾元素.
答案:A.K2CO3;B.KOH;C.KHCO3;D.KCl;化学方程式为:2KHCO3 K2CO3+CO2↑+H2O;K2CO3+CO2+H2O
= 2KHCO3;KOH+KHCO3
= K2CO3+H2O
K2CO3+CO2↑+H2O;K2CO3+CO2+H2O
= 2KHCO3;KOH+KHCO3
= K2CO3+H2O

[同步达纲练习]
0.91g W
W=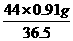 =1.1g
=1.1g
所以,两种情况下产生的CO2的质量比是2.75g∶1.1g=5∶2.
答案:C.
例5 由某碱金属(R)及其氧化物(R2O)组成混合物4.0g与水充分反应后,蒸发反应后的溶液,得到5.0g无水晶体.试通过计算确定该金属元素的名称.
解析:本题若用常规方法求解,非常麻烦.若用极端假设法,则可事半功倍.用极端假设法解题的一般方法是:以问题的两个极端去提出假设,求出极值(最大值或最小值)后,确定一个取值范围,利用这个取值范围进行推理、判断,使问题得到解决.可见,本题虽是一道化学计算题,但其中除了包含着的化学原理之外,还隐含着数学理念.本题的化学原理比较简单,不过是两个反应式,即:
2R+2H2O = 2ROH+H2↑
R2O+H2O = 2ROH
显然,无论是R,还是R2O与水反应的结果都必然最终导致固体的质量增加.假定该混合物是由单一成分组成的纯净物,可计算出该原子的相对原子质量的取值范围.
解答:设碱金属R的相对原子质量为x,则R2O的相对分子质量为2x+16.
若全为金属,则有关系式: 若全为氧化物,则有关系式:
R → ROH R2O → 2ROH
x x+17 2x+16 2(x+17)
36.5 44
36.5 106 84
Y 10.6g W
y=3.65g W=8.4g
这时,剩余HCl的质量=4.56g-3.65g=0.91g.
显然,在接下来的反应中,应按HCl的质量来算产生的CO2的质量.
HCl + NaHCO3=NaCl+ CO2↑+H2O
4.56g x
x=2.75g
在第二种情况下,应分步计算,设生成NaHCO3所消耗HCl的质量为Y,生成NaHCO3的质量为W,最后产生的CO2的质量为Z.
HCl + Na2CO3= NaHCO3+NaCl
有一类化学计算题,由于某一条件的不确定,结果可能是两个或两个以上,也可能在某个范围内取值,这类题就需要用讨论的方法求解.近几年高考中出现的涉及讨论的试题主要有四种类型:①讨论反应发生的程度;②讨论反应物是否过量;③讨论反应物或生成物的组成范围;④讨论不定方程的解.
前三种类型的讨论题一般思路是:①首先利用有关反应方程式(或加工变形的关系式)确定两种反应物恰好完全作用时,各反应物和生成物的具体的量的关系;②然后再按某一反应物的量不足或过量分别讨论;③最后将①②联系起来找出各种情况下对应的答案或取值范围.
对不定方程的讨论,需充分利用题目中给出的条件,有选择范围地讨论.
[难题巧解点拨]
例1 某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8g样品加入足量水中,样品全部溶解.再加入过量的CaCl2溶液,得到9g沉淀.对样品所含杂质的正确判断是( )
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能含有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
解析 将13.8g样品加入足量的水,样品全溶解则样品中一定无Ba(NO3)2(因能与K2CO3生成沉淀).下面用极值法分析:如13.8g是纯的K2CO3,则生成CaCO3沉淀应为10g,而现在得沉淀9g,则混进的杂质或不与CaCl2生成沉淀,或13.8g杂质与CaCl2作用生成的沉淀小于9g.杂质中KNO3不与CaCl2生成沉淀,符合题意.而13.8gNa2CO3与CaCl2混合生成沉淀为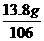 ×100>9g不合理.所以选项A正确.但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8g样品与CaCl2反应后只生成9g沉淀,故B正确.选项B很容易漏掉.故选A、B.
×100>9g不合理.所以选项A正确.但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8g样品与CaCl2反应后只生成9g沉淀,故B正确.选项B很容易漏掉.故选A、B.
评析 此题考查学生思维的严密性.
例2 18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分的反应后排出气体,冷却,称得剩余固体质量为16.6g.试计算原混合物中NaOH的百分含量.
解析 解法Ⅰ 混合物加热时的化学方程式为:
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2NaOH+CO2 = Na2CO3+H2O
综合为:
NaHCO3+NaOH Na2CO3+H2O
Na2CO3+H2O
84 40
124 106
假设18.4g混合物恰好按84∶40比例混合,设加热后剩余固体为x,则
124∶106=18.4g∶x x=15.7g而实际16.6g,可见NaOH过量.设NaHCO3质量为y,NaOH为18.4g-y
NaOH+NaHCO3=Na2CO3+H2O
84 18
y 18.4g-16.6g=1.8g
y=8.4g
∴NaOH%= ×100%=54.3%
×100%=54.3%
解法Ⅱ 判断混合物中哪种物质过量还可以根据差值法,因为NaOH受热时不分解,所以:
NaOH+NaHCO3 Na2CO3+H2O
Na2CO3+H2O
40 84
124 18
18.4g x
x=2.67g>1.8g,说明NaOH过量.
解法Ⅲ 设混合物由等摩尔比组成,并设形成1.8g(18.4g-16.6g)差量时消耗混合物的质量为m,则124∶18=m∶1.8g m=12.4g 因为原混合物为18.4g形成1.8g差值只需12.4g,所以余下18.4g-12.4g=6g,这6g不是NaHCO3而是不分解的NaOH,说明NaOH过量.以下解法同上.
评析 许多计算题并不明显给出已知条件,初审时感到条件不足,这时就要仔细分析,挖掘隐含条件.本题的关键是要判断NaOH和NaHCO3在反应时哪一种过量.而题目的条件只是反应前后的固体混合物的质量变化,NaOH与NaHCO3按不同比例混合时,引起的质量减小也不同,再与已知条件相比较,即可判断是哪种物质过量.
[典型热点考题]
例1 关于锂的结构和性质的判断,错误的是( )
(1)与水反应比钠剧烈
(2)它的原子半径比钠小
(3)它的氧化物暴露于空气易吸收二氧化碳
(4)它的阳离子最外层电子数和钠的相同
(5)它是还原剂
A.只有(1) B.(3)和(5) C.(2)和(3) D.(1)和(4)
解析:该题为碱金属元素性质的判断题,解此题的关键是注意对碱金属元素的相似性、差异性和递变性的理解和掌握.(1)钠比锂的金属性强,所以锂与水反应不如钠剧烈,此项说法错误.(2)锂原子的电子层为2层,钠原子有3个电子层,所以前者比后者原子半径小.此项正确.(3)氧化锂与氧化钠相似,也是碱性氧化物,易吸收酸性氧化物二氧化碳变为碳酸盐.(4)锂离子Li+最外层只有2个电子,而钠离子Na+最外层有8个电子,此项说法错误.(5)锂也是活泼金属,它在反应中只能作还原剂.故答案为D.
例2 下列关于钾、钠、铷、铯的叙述中不正确的是( )
A.其氢氧化物中碱性最强的是CsOH
B.氧化能力最强的是钠原子
C.原子半径随核电荷数的增大而增大
D.单质的密度均小于1g/cm3
解析:在Na、K、Rb、Cs四种碱金属中,Cs的金属性最强,所以CsOH的碱性最强,A选项正确;钠原子只能失去电子,不能得到电子,即钠原子没有氧化性,B选项错误;核电荷数越大,电子层数越多,原子半径越大,C选项正确;从Na→K→Rb→Cs,碱金属的密度逐渐增大,K、Na的密度小于1g·cm-3,但Rb、Cs的密度大于1g·cm-3,D选项错误.
答案:B、D.
例3 某物质燃烧时,焰色为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物 B.该物质中一定含有钾元素
C.该物质一定是金属钠 D.该物质中一定含有钠元素
解析:所谓焰色就是指一些发光物质,当加热提供其一定的能量时,自身便可发出各种颜色的光.由此看出它的能量转换是提供的能量直接转变成光能.这一点与白炽灯的工作能量转换有着明显的区别,正因为如此,发光物质的研究才是当今的活跃科技领域之一.那么发光物质的发光是由原子产生的,还是由离子产生的呢?请注意下列事实:①路边的照明灯发出光多为黄色,原因是路灯里装入的是纯净的金属钠,当通电后钠汽化,钠原子接受电能并将其转化为光能,从而产生黄光.用这种路灯有两大好处:一是省电,二是光的亮度是同功率白炽灯的几倍至几十倍.②我国每逢重大的庆祝活动或重大的节日,有放焰火的习惯,若放出黄色焰火,则制造焰火的原料必有NaCl,因为Na+产生的焰色是黄色的.由此可以看出:发光物质的颜色既不能断言是离子的,也不能确认是原子的,所以说焰色反应是元素的行为.
答案:D.
例4 将含Na2CO310.6g的Na2CO3溶液100mL逐滴滴加到100g4.56%的盐酸中与将100g4.56%的盐酸逐滴滴加到含Na2CO310.6g的Na2CO3溶液100mL中,两者所产生的气体的质量比是( )
A.1∶1 B.2∶5 C.5∶2 D.2∶1
解析:将Na2CO3加到盐酸中(相对而言,过程中酸过量)与将盐酸加到Na2CO3中(相对而言,过程中Na2CO3过量),两者发生的反应是有区别的.
第一种情况:Na2CO3+2HCl=2NaCl+CO2↑+H2O
第二种情况:HCl+Na2CO3=NaHCO3+NaCl
HCl+NaHCO3=NaCl+H2O+CO2↑
现Na2CO3质量为10.6g,HCl质量为4.56g,在第一种情况下,应按HCl的质量来算产生的CO2的质量.设产生CO2的质量为x:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
2.差异性、递变性
(1)原子结构.从Li→Cs随着核电荷数的递增,电子层数增加,原子半径增大.
(2)化学性质.
①随着原子半径的逐渐增大,原子核对最外层电子的引力逐渐减弱,使得原子失电子的能力逐渐增强,则金属的还原性也逐渐增强.
②随着核电荷数的增加,碱金属元素的最高价氧化物的水化物的碱性逐渐增强.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com