
题目列表(包括答案和解析)
3.下列各组元素的原子随着原子序数的递增,有关递变不正确的是( )
A.原子半径:C>N>O>F B.金属性:Na<K<Rb<Cs
C.最高正价:P<S<Cl<Ar D.最外层电子数:Na<Mg<Al<Si
2.在IIA族中,Be是惟一可以生成含氧酸根(铍酸根离子:BeO22-)的元素,与铍的性质相似的短周期元素是 ( )
A.Na B.Mg C.Al D.Si
1.下列叙述不正确的是( )
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Mg(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的氧化性依次减弱
D.H4SiO4、H2CO3、H2SO4酸性依次增强
14.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
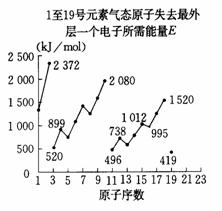 ⑴同主族内不同元素的E值变化的特点是 __ ___。
⑴同主族内不同元素的E值变化的特点是 __ ___。
各主族中E值的这种变化特点体现了元素性质的
____ __ ___变化规律。
⑵同周期内,随原子序数增大,E值增大,但个别元
素的E值出现反常现象,试预测下列关系式中正确
的是___________(填写编号,多选倒扣)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
⑶估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
__ _ ___<E<___ __。
⑷10号元素E值较大的原因是___________________________________。
第三节 元素周期表(课时三)
13.由1H、2H、3H、35Cl、37Cl组成的氯化氢分子中,用精密的仪器检测这些分子,可测出____________种氯化氢分子,氯化氢分子的式量有____ ____种。
12.物质的量相同的H2O和D2O相比较,所含氧原子数之比为 ,相对分子质量之比为 ,质量之比为 ;与足量钠反应,放出的气体在标况下的质量之比为
11.在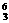 Li、
Li、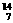 N、
N、 Na、
Na、 Mg、
Mg、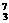 Li、
Li、 C几种核素中:
C几种核素中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
10.X、Y、Z三种元素,它们的原子序数均小于20,X元素的原子最外电子层只有一个电子,Y元素的原子M层的电子数是K层和L层电子总数的1/2,Z元素原子L电子层比Y元素原子的L层少2个电子,由X、Y、Z组成的化合物的化学式不可能是( )
A.X2YZ2 B. XYZ3 C. X3YZ4 D. X4YZ4
9.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积在标准状况下为33.6L。在所生成的气体中,重氢D和普氢H的原子个数比为( )
A. 2:3 B.2:5 C.1:2 D. 1:3
8.A、B两种元素位于短周期,A原子半径小于B原子半径,两种元素可以形成A显正价的AB2型化合物,下列有关A、B两种元素的叙述中正确的是( )
A.A、B可能位于同一周期 B. A只能是金属元素
C.A只能位于B的下一周期
D. A可能是第二周期中的第ⅡA族元素,或第ⅣA族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com