
题目列表(包括答案和解析)
1.下列说法正确的是( )
A.锗、硅元素的单质都是半导体材料 B.CH4、SiH4、GeH4的稳定性依次减弱
C.H2CO3、H2SiO3、H2GeO3的酸性依次增强 D.C、Si、Ge、Sn、Pb的熔 、沸点依次升高
31.现有物质的量浓度为18.4 mol/L的浓硫酸20.0 mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水到100.0 mL,测得溶液中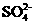 的物质的量浓度为3.18 mol/L.试求该100.0 mL溶液中
的物质的量浓度为3.18 mol/L.试求该100.0 mL溶液中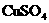 的物质的量浓度.
的物质的量浓度.
30.图1虚线框中的装置可用来检验浓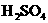 与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
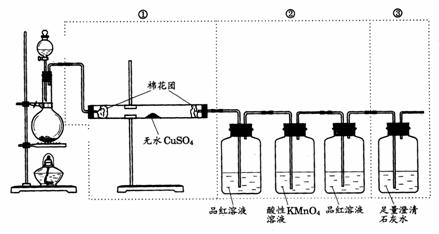
图1
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是________;不能检出的物质是_____________.
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________;不能检出的物质是________.
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________.
29.有物质A-I,它们之间的相互转化关系如下图所示.已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水,呈弱酸性,它能与氧化物A发生非氧化还原反应生成C和另一种化合物.据此,请回答:
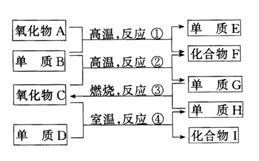
(1)化合物F是________.
(2)化合物I是________.
(3)反应③的化学方程式是___________.
(4)反应④的化学方程式是___________.
28.有原子序数均小于20的A、B、C、D四种元素,已知:①A和B在同一主族,C和D在同一周期;②四元素相互间可形成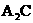 、
、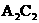 、
、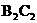 、
、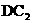 等化合物;③B的阳离子与C的阴离子核外电子层结构相同;④
等化合物;③B的阳离子与C的阴离子核外电子层结构相同;④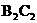 与
与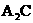 或
或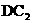 反应都生成
反应都生成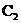 气体;⑤B的单质与
气体;⑤B的单质与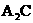 反应生成
反应生成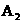 气体,
气体,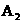 与
与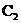 混合遇火可发生爆炸,生成常温下无色、无味的液体
混合遇火可发生爆炸,生成常温下无色、无味的液体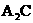 .试回答:
.试回答:
(1)写出A和D两元素的名称:A________、D________;画出B离子和C离子的结构示意图________,两种离子中,半径较小的是________.
(2)写出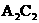 、
、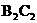 、
、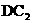 的电子式,指出所含化学键类型:
的电子式,指出所含化学键类型:
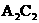 __________,__________;
__________,__________;
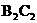 __________,__________;
__________,__________;
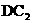 __________,__________.
__________,__________.
(3)写出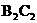 与
与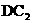 反应的化学方程式__________.
反应的化学方程式__________.
27.物质的组成可用不同形式表示.
(1)将下列硅酸盐改写成氧化物形式(改写时金属氧化物在前,非金属氧化物在后,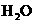 一般放于最后):
一般放于最后):
①镁橄榄石(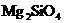 )_____________
)_____________
②高岭石(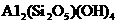 )_____________.
)_____________.
(2)许多含氧酸及其盐均可改写成氧化物形式表示组成,试改写以下物质: ________,HCOOH(甲酸)________,
________,HCOOH(甲酸)________, (明矾,十二水合硫酸铝钾)________.
(明矾,十二水合硫酸铝钾)________.
通过以上改写,可知 的酸酐为________,HCOOH与浓
的酸酐为________,HCOOH与浓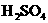 反应可制取________气体.
反应可制取________气体.
26.氢元素有H、D、T三种同位素,它们可形成________种氢分子,化学式分别为________.
25.有一瓶无色气体,可能含有HCl、 、
、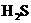 、HBr和
、HBr和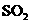 中的一种或几种.将其通入氯水中,得到无色透明溶液.将溶液分成两份,向一份中加入盐酸酸化的
中的一种或几种.将其通入氯水中,得到无色透明溶液.将溶液分成两份,向一份中加入盐酸酸化的 溶液,出现白色沉淀;向另一份中加入
溶液,出现白色沉淀;向另一份中加入 酸化的
酸化的 溶液,也有白色沉淀生成.以下结论正确的是( ).
溶液,也有白色沉淀生成.以下结论正确的是( ).
①原气体肯定有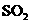 ②原气体中可能有
②原气体中可能有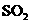 ③原气体中肯定无
③原气体中肯定无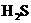 和HBr ④不能确定原气体中是否有HCl ⑤原气体中肯定没有
和HBr ④不能确定原气体中是否有HCl ⑤原气体中肯定没有 ⑥原气体中肯定有HCl
⑥原气体中肯定有HCl
A.①③④ B.①④⑤ C.①③⑥ D.①③⑤⑥
24.通常状况下,将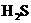 和
和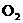 的混合气体24mL点火燃烧,生成6mL
的混合气体24mL点火燃烧,生成6mL 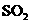 ,若反应后
,若反应后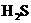 、
、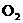 均无剩余,原混合气体中
均无剩余,原混合气体中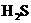 的体积为( ).
的体积为( ).
A.6mL B.12mL C.15mL D.18mL
23.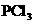 分子的空间构型是三角锥形而不是平面正三角形.下列关于
分子的空间构型是三角锥形而不是平面正三角形.下列关于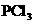 分子空间构型理由的叙述中正确的是( ).
分子空间构型理由的叙述中正确的是( ).
A.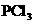 分子中三个共价键的键长、键角都相等
分子中三个共价键的键长、键角都相等
B.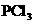 分子中P-Cl键属于极性共价键
分子中P-Cl键属于极性共价键
C.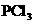 分子中三个共价键的键长、键角均相等,且属于极性分子
分子中三个共价键的键长、键角均相等,且属于极性分子
D.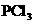 分子中P-C1键的三个键角都是100.1°,键长相等
分子中P-C1键的三个键角都是100.1°,键长相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com