
题目列表(包括答案和解析)
24.(7分)在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2。
⑴计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
⑵将上述溶液蒸干、灼烧,可以得到Na2CO3多少克?
23.(6分)将标准状况下13.44 L氯化氢气体溶解于水后配成50.0 mL溶液,得到密度为1.19 g·cm-3的盐酸。试计算:
⑴所得盐酸的物质的量浓度。
⑵该盐酸中溶质的质量分数。
22.(8分)根据下列反应框图填空。已知B、D、E、L常温下均为密度比空气大的气体,D呈黄绿色,其他无色,D、E为单质,其他为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,G难溶于水,L能使湿润的蓝色石蕊试纸变红。
 ⑴F的俗名是__________________;
⑴F的俗名是__________________;
⑵反应①的用途是____________________________________________;
⑶反应②在实验室常被用来____________________________________;
⑷工业上利用反应③生产______________________________________;
⑸另有两种物质能与H反应生成E,写出这两个反应的化学方程式:
_______________________________________________
_______________________________________________
21.(4分)某固体混合物可能由KNO3、K2SO4、CaCl2、NaCl、CuCl2、Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
①用干净的铂丝蘸取混合物在酒精灯火焰上灼烧,透过蓝色的钴玻璃,可以观察到火焰呈紫色;
②混合物加水得到无色溶液;
③向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀硝酸;
④向③的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此,可判断混合物中肯定含有 ,不能肯定是否含有 (均用化学式填写)。
20.(9分)为探究氯水中除H2O分子外还含有哪些粒子,某化学兴趣小组做了如下实验:
⑴观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是(填化学式,下同)______________;
⑵取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是___________;
⑶另取少量氯水于表面皿中,将一块蓝色石蕊试纸置于其中,发现试纸先变红然后褪色,说明氯水中含有的粒子是_________和_________;
⑷以上实验不能说明溶液中是否有_________________存在;
⑸通过以上实验说明氯气与过量的水的反应是___________(填“完全”、“不完全”)的,因此氯气与水的反应是一个____________(填“可逆”、“不可逆”)反应,该反应的离子方程式是_________________________________________。
19.(4分)人们常利用化学反应中的能量变化为人类服务。
⑴将30 g碳酸钠晶体与20 g硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温。当外出旅游时,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量__________(填“高于”或“低于”)反应后生成产物的总能量。
⑵煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与下列示意图中的_________(填字母代号)最相符。
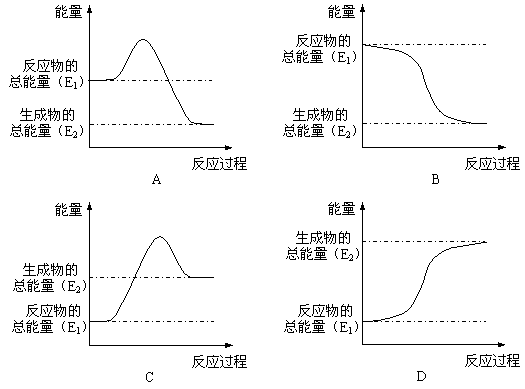 ⑵化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这是将化学能转化为___________;人们普遍使用的干电池,是将化学能转化为___________。
⑵化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这是将化学能转化为___________;人们普遍使用的干电池,是将化学能转化为___________。
18.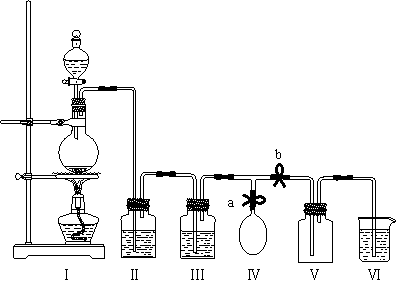 (10分)某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
(10分)某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
⑴写出该反应的化学方程式并标出电子转移的方向和数目。
⑵装置Ⅲ中盛放的药品是_____________,其作用是________________________。
⑶装置Ⅵ中盛放的药品是_____________,其作用是________________________。
⑷实验开始后,___________________________________________(用“打开”或“关闭”等简洁的语言叙述对弹簧夹a和b的操作,下同);当集满一瓶氯气时,_________ ____________________________,使氯气储存在气球中;换好集气瓶后,_____________ __________________________,继续收集氯气。
17.(4分)要配制浓度为2.0 mol·L-1 的NaOH溶液100 mL,下面的操作不正确的是____________(填代号)。
A.称取8.0 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8.0 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8.0 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.称取8.0 g NaOH固体,放入100 mL烧杯中,加少量蒸馏水同时不断搅拌,待固体完全溶解后,趁热将烧杯中的溶液倒入100 mL容量瓶中,然后加入蒸馏水到刻度,盖好瓶塞,反复摇匀
16.在50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中滴入过量的硝酸银溶液,充分搅拌、静置、过滤、洗涤、干燥,称量得到2.87 g固体。由此可得出的正确结论是
A.氯离子全部参加了反应
B.氟离子全部参加了反应
C.氟化银难溶于水
D.氟化银易溶于水
第Ⅱ卷(非选择题 共52分)
15.为消除碘缺乏病,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在酸性溶液中IO3-离子可和I-离子发生反应:IO3-+5I-+6H+=3I2+3H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。
进行上述实验时必须使用的物质是
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com