
题目列表(包括答案和解析)
14.44 mol / L×V=3 mol / L×100 mL
V=20.8 mL
4.实验室常用的65%的稀硝酸,密度为1.4 g / cm3,计算该溶液中HNO3的物质的量浓度。若要配制3 mol / L的硝酸100 mL,需要这种浓硝酸多少硝酸?
答:14.4 mol / L;20.8 mL。
解:c=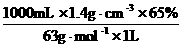 =14.44 mol / L
=14.44 mol / L
3. (1) 29.8% (2) 15.8 mol / L
解析:(1) n(NH3)=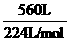 =2.5 mol,
=2.5 mol,
m(NH3)=2.5 mol×17 g / mol=425 g,
w=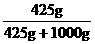 ×100%=29.8%,
×100%=29.8%,
(2) c=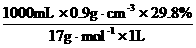 =15.8 mol / L
=15.8 mol / L
或:V=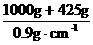 =1583 mL=1.583 L,
=1583 mL=1.583 L,
c=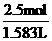 =15.8 mol / L。
=15.8 mol / L。
3.用1体积水吸收了560体积的氨(标准状况),所得氨水的密度为0.9 g / cm3。计算:
 (1) 该氨水中溶质的质量分数。
(1) 该氨水中溶质的质量分数。
(2) 该溶液的物质的量浓度。(注:1 mL水按1 g计算)
2. 设原溶液的质量为x,0.22 x=0.14(x+100 g)
x=175 g,
n (NaNO3)=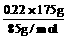 =0.453 mol,
=0.453 mol,
c=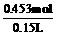 =3.0 mol / L。
=3.0 mol / L。
2.某温度下22% NaNO3溶液150 mL,加入100 g水稀释后溶质质量分数变为14%。求原溶液的物质的量浓度。
1.在200 mL稀盐酸里溶有0.73 g HCl,计算溶液中溶质的物质的量浓度。
答:0.1 mol / L。
4. (1) 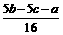 ;
;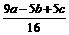 (2) 13 (3) 越大;<b-
(2) 13 (3) 越大;<b-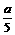
4.有氯化亚铁、氯化铜混合溶液400 mL,经测定其中Cl-浓度是a mol / L。投入过量的锌粉b g,充分反应后过滤,所得固体残渣洗涤干燥后,质量为c g。
(1) 求原混合溶液中Fe2+是_________ mol / L,Cu2+是_________ mol / L。
(2) b的值应大于_______a g。
(3) c的数值越大,说明混合液中氯化铜含量___________;c的最大值(以a-b表示)应是_______________g。
3. (1) [2]、[1]、[6]、[3]、[5]、[4] (2) a 将浓硫酸沿烧杯壁慢慢注入盛有一定量蒸馏水的烧杯中,并用玻璃棒小心搅拌均匀。 b 量筒应放平稳,向量筒内慢慢注入硫酸,读数时视线与液面最低点保持水平。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com