
题目列表(包括答案和解析)
17.用酒精灯加热34.6g KMnO4和Cu(NO3)2混合物,使其中的两种物质全部分解,生成的气体全部通入100 mL 4℃时的水中,待生成的气体与水充分反应后,还逸出1.12 L无色气体(标准状况下测定),所得溶液的密度为1.05 g/mL。求:
(1) 原混合物中各组成成分的质量;
(2) 所得溶液的物质的量浓度是多少?
(注:2Cu(NO3)2  2CuO+4NO2↑+O2↑)
2CuO+4NO2↑+O2↑)
 36. (1) 2KMnO4
36. (1) 2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
2Cu(NO3)2  2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
4NO2+O2+2H2O = 4HNO3
所以,逸出的气体是O2,且为 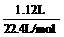 =0.05 mol,
=0.05 mol,
故混合物中含KMnO4为 0.05 mol×2×158 g / mol=15.8 g,
Cu(NO3)2为 34.6 g-15.8 g=18.8 g
(2) 因为原混合物中Cu(NO3)2为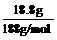 =0.1 mol,
=0.1 mol,
所以NO2为0.2mol,O2为0.05mol。
又因为溶液体积为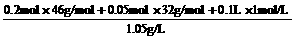 =105.52 mL,
=105.52 mL,
所以,所得溶液的物质的量浓度为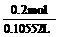 =1.895 mol / L
=1.895 mol / L
16.有Na2SO4和Na2CO3混合溶液10.0 mL,加入足量BaCl2溶液,充分反应后,经过滤、洗涤和烘干,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL CO2 气体(标准状况)。求原混合溶液中Na2SO4和Na2CO3的物质的量浓度。
解.:Na2SO4+BaCl2 = 2NaCl+BaSO4↓
Na2CO3+BaCl2 = 2NaCl+BaCO3↓
BaCO3+2HCl = BaCl2+H2O+CO2↑
n (Na2CO3) = n (BaCO3) = n (CO2) = 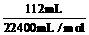 = 0.005 mol
= 0.005 mol
m (BaCO3) = 0.005 mol×197 g / mol = 0.985 g
m (BaSO4) = 1.451 g-0.985 g = 0.466 g
n (Na2SO4) = n (BaSO4) = 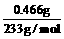 = 0.002 mol
= 0.002 mol
c (Na2SO4) = 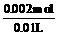 =0.2 mol / L
=0.2 mol / L
c (Na2CO3) = 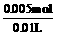 =0.5 mol / L
=0.5 mol / L
15.有未知浓度的盐酸25 mL,能跟20 mL某浓度的NaOH溶液完全反应。若先用0.1 g CaCO3与25 mL这种酸作用,剩余的酸需用上述NaOH溶液4 mL才能中和。求盐酸和NaOH溶液中溶质的物质的量浓度。
解:HCl+NaOH=NaCl+H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
n(CaCO3 )=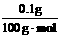 =0.001 mol
=0.001 mol
n(HCl )=2n(CaCO3 )=0.002 mol
由题意知,4 mLNaOH溶液将消耗5 mL盐酸,与反应的盐酸为25 mL-5 mL=20 mL。
c(HCl )=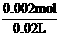 =0.01 mol / L
=0.01 mol / L
n(NaOH )=n(HCl )=0.01 mol / L×0.025 L=0.0025 mol
c(NaOH )=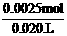 =0.125 mol / L
=0.125 mol / L
或:c(NaOH )=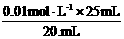 =0.125 mol / L
=0.125 mol / L
14.向部分被氧化的Zn粉7.31 g中逐滴加入1 mol / L盐酸(密度1.015 g / cm3),当加到220 mL时,锌粉恰好与盐酸完全反应。求所得氯化锌溶液的物质的量浓度(设反应后溶液体积仍为220 mL ),及溶质的质量分数。
解:设Zn和ZnO的物质的量分别为x、y,
Zn+2HCl=ZnCl2+H2↑ ZnO+2HCl=ZnCl2+H2O
x 2x y 2y
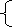 65 g / mol×x+81 g / mol×y=7.31 g
65 g / mol×x+81 g / mol×y=7.31 g
2x+2y=1 mol / L×0.22 L=0.220 mol
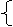 65 g / mol×x+81 g / mol×y=7.31 g
65 g / mol×x+81 g / mol×y=7.31 g
 -65 g / mol×x-65 g / mol×y=-7.15 g
-65 g / mol×x-65 g / mol×y=-7.15 g
16 g / mol×y=0.01 g
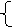 y=0.01mol
y=0.01mol
x=0.1mol
n(ZnCl2)=0.1mol+0.01mol=0.11 mol
 c(ZnCl2)=
c(ZnCl2)=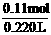 =0.5 mol / L
=0.5 mol / L
w(ZnCl2)=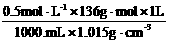 =6.7%
=6.7%
13.有一瓶14%的KOH溶液,加热蒸发掉100 g水,变成28%的KOH溶液80 mL,这80 mL溶液的物质的量浓度为多少?
解:增浓,溶质质量不变。
w(浓aq)×m(浓aq)=w(稀aq)×m(稀aq)
已知:m(浓aq)=m(稀aq)+100 g
现设浓溶液的质量为x,
28%×x=14%(x+100 g)
2x=x+100 g
x=100 g
n(KOH )=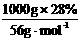 =0.5 mol
=0.5 mol
c(KOH )=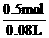 =6.25 mol / L
=6.25 mol / L
12.把100 mL 0.1 mol / L盐酸与200 mL 0.05 mol / L硫酸溶液混合(体积变化忽略不计),则溶液中H+ 的物质的量浓度为多少?
解:c(H+ )=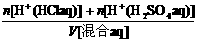
 =
=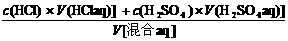
=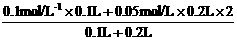 =0.1 mol / L
=0.1 mol / L
由于盐酸的体积是硫酸体积的2倍,而H+ 浓度后者是前者的2倍,故可用下式计算:
c(H+ )=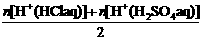
=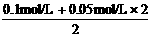 =0.1 mol / L
=0.1 mol / L
其实,两者氢离子浓度相同,故有下列结论:某物质或离子的浓度相同的溶液混合,其相应物质或离子的浓度不变。
11. (1) 33.2 g (2) 25% (3) 3.9 mol / L
解:(1) S=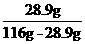 ×100 g=33.18 g,
×100 g=33.18 g,
(2) w=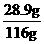 ×100%=25%,
×100%=25%,
(3) n=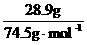 =0.388 mol,
=0.388 mol,
c=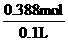 =3.9 mol / L
=3.9 mol / L
11.24℃时,100 mL KCl饱和溶液的质量为116 g,如将这些溶液蒸干,获得KCl晶体28.9 g。求:
(1) 24℃时KCl的溶解度。
(2) KCl饱和溶液中溶质的质量分数。
(3) KCl饱和溶液中溶质的物质的量浓度。
10. (1) 26.3% (2) 3.19 mol / L (3) 15.67 mL
10.用98%浓H2SO4(密度为1.84 g /cm3)配成1∶5的H2SO4溶液(密度为1.19 g /cm3)。
(1) 求这种H2SO4溶液中溶质的质量分数;
(2) 所得稀H2SO4中溶质的质量分数;
(3) 如果用所得稀H2SO4来配制0.1 mol / L的H2SO4溶液500 mL,问应该怎样配制?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com