
题目列表(包括答案和解析)
11. 2007年10月是索尔维制碱法命名140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。该法广泛为世界各国采用,后被中国的侯氏制碱法所取代。索尔维法的生产流程是:

索尔维法能实现连续生产,但食盐利用率只有70﹪,且副产品CaCl2没有用途,污染环境。
 1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96﹪,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96﹪,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
①在30℃-50℃的饱和食盐水中,先通入氨饱和,再通入CO2得碳酸氢钠沉淀。
②过滤,将滤渣加热而得副产品。
③在滤液中加入细食盐末,在10℃-15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水。
请完成下列问题:
(1)在氨的饱和NaCl溶液中通入CO2的两步反应方程式:
______ ___________。
(2)不能在NaCl溶液中通入CO2制NaHCO3的原因是____________________。
 (3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(4)在“侯氏制碱法”中,_______物质可以循环利用,在“索尔维法”中___________物质可以循环利用。
(5)“侯氏制碱法”与“索尔维”相比,其优点是___________。
13. 将30.0 gFe粉(过量)与50.0 mL浓硫酸在加热条件下充分反应,共收集到11.2 L(标况)气体(设生成的气体全部逸出),其质量为19.6 g。试计算:
⑴浓H2SO4的物质的量浓度
⑵反应后剩余铁粉的质量
⑶判断反应后的所得溶液能否与氯气反应?如能,请写出反应的离子方程式并计算所需氯气的物质的量;如不能,请说明理由。
12. 为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前应首先检查装置A的气密性,可以采取的操作是
(2)C、E两处装置中应盛放的试剂分别为:C ;E ;
(3)此实验成功的关键在于控制反应产生的气体通过C、D、E三个装置的速率不能过快,由此设计一个虚框部分的装置,则对于下列三步操作正确的先后顺序是(用操作编号填写) 。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中的气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为 。
(5)当D装置的右管的产生 现象且E中出现 现象时,可以充分说明产生的气体中有CO2。装置D的作用为 。
11.常温下,将铁粉与硫粉混合,不发生反应。某课外活动活动小组将铁粉和硫粉按物质的量比1:1均匀混合,并置于水平放置且隔绝空气的玻璃管中,加热片刻,反应开始,然后撤去酒精灯,发现反应仍剧烈进行,并使生成的固体呈红热状态。试回答:
(1)上述现象说明了
(2)将生成的黑色固体置于稀硫酸中,有气体放出,写出发生反应的离子方程式
(3)已知硫化氢是剧毒、有刺激性气味的气体,试说明实验室制取硫化氢时应采用的安全措施:
13. 为了预防碘缺乏病,国家规定每kg食盐中应含有40-50mg的碘酸钾。为检验某种食盐中是否为加碘的合格食盐,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用 的硫代硫酸钠(Na2S2O3)溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品,有关反应如下:
的硫代硫酸钠(Na2S2O3)溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品,有关反应如下:
IO3-+5I-+6H+===3I2+3H2O;I2+2S2O32-=== S4O62-+2I-。
9. 下列框图中,G具有漂白性,F可循环利用,
下列框图中,G具有漂白性,F可循环利用,
H常温下为液体。请回答:
(1)写出A、C、D、E、F、G的化学式。
A C
D E
F G
(2)写出下列反应的化学方程式:
饱和食盐水→A+B+C 。
B+C→E+F+H 。
D+E→G 。
12. 从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。


试回答下列问题:
(1)写出用海滩上的贝克制取Ca(OH)2的化学方程式:
 。
。
(2)写出电解饱和氯化钠溶液的化学方程式: ,
(3)写出电解熔融氯化镁制取镁的化学方程式: 。
(4)将电解生成的氯气通入氢氧化钠溶液中可得到一种消毒液,写出反应的化学方程式:
。
(5)从经济效益角度看,该化工厂的厂址应选择在 。
(6)粗盐中常含有Ca2+、Mg2+等杂质,可用Na2CO3、NaOH除去。精制过程发生反应的离子方程式为 、 。
(7)如果粗盐中SO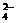 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO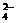 ,该钡试剂可以是
(选填a、b、c)
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
,该钡试剂可以是
(选填a、b、c)
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(8)为有效除去Ca2+、Mg2+、SO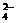 ,加入试剂的合理顺序为
(选填a,b,c)
,加入试剂的合理顺序为
(选填a,b,c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
11. 一硬质玻璃管的两端装有带导管的塞子,左、中、右分别放有3个湿棉球(如图所示)。c球浸有淀粉碘化钾溶液;b球浸有碘化钾浓溶液;a球浸有溴化钾溶液。实验时,从右端缓缓通入氯气,同时在b处微热,并逐渐向左移动酒精灯。则可观察到:在a处有____色的____产生;在b处有____色的____产生;c球变成____色;稍冷却后,b、c之间的管壁上有____色的____析出。通过实验可以判定Cl2、Br2、I2的氧化性____最强,Cl-、Br-、I-的还原性_____最弱。

18(2分)已知 五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是____
____。
五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是____
____。
19(7分)、重水的组成是D216O,则1mol重水中含质子 个,1g重水中含电子 个,10g重水含中子 个。10个重水分子与10个普通水分子其质量之比是 ,物质的量之比是 ,质子数之比是 ,中子数之比是 。
20(12分)(1)下列物质中:N2、H2O、Ar、Na2O2、CaCl2、KOH、NaF,只含有共价键的物质是 ;只含有离子键的物质是 ;既含有离子键又含有共价键的物质是 。
(2)在H、Na、O、Cl四种元素中,由两种元素组成的离子化合物有(写3种化合物)
;由两种元素组成的共价化合物有(写3种化合物) 。
 21(6分)、下列各题中的物质均为由核电荷数1-10的元素组成。请填写化学式:
21(6分)、下列各题中的物质均为由核电荷数1-10的元素组成。请填写化学式:
(1)只有两个电子和两个原子核组成的分子 。
(2)1个最外层有5个电子和3个只有1个电子的原子结合的分子是 。
(3)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合的分子是 。
 (4)由3个最外层是6个电子的原子结合而形成的分子是
。
(4)由3个最外层是6个电子的原子结合而形成的分子是
。
(5)由两个原子核10个电子结合而成的分子是 ,由5个原子核10个电子结合成的分子是 。
22(5分)、现有A、B、C三种元素,B原子序数大于A,A与B的质子数之和为27,质子数之差为5,0.9g单质C与足量盐酸作用放出1.12L氢气(标况),且生成C的三氯化物。回答下列问题:
(1)(填元素符号)A是 ,B是 ,C是 。
(2)写出C元素的最高价氧化物对应的水化物分别与A、B元素的最高价氧化物对应的水化物反应的离子反应方程式 、
23(17分)、下表是元素周期表的一部分,回答下列有关问题:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
⑩ |
 |
|
|
|
|
 |
|
(1)写出下列元素符号:①______,⑥______,⑦______, (11)______。
(2)在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______。
(4)在这些元素中,原子半径最小的是______,原子半径最大的是______。②、③、④离子半径排序: 。
 (5)在③与④中,化学性质较活泼的是______,怎样用化学实验证明?答:___
__ _ 。在⑧与 中,化学性质较活泼的是______ ,怎样用化学实验证明?答:__
____
。
(5)在③与④中,化学性质较活泼的是______,怎样用化学实验证明?答:___
__ _ 。在⑧与 中,化学性质较活泼的是______ ,怎样用化学实验证明?答:__
____
。
高一化学第二学期期中检测试题(A卷)
17.对于A2 + 3B2  2C的反应来说,以下化学反应速率中,最快的是: ( )
2C的反应来说,以下化学反应速率中,最快的是: ( )
A.v(B2) = 0.8 mol/(L•s) B.v(A2) = 0.4 mol/(L•s)
C.v(C) = 0.6 mol/(L•s) D.v(B2) = 0.2 mol/(L•s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com