
题目列表(包括答案和解析)
0.010 mol 0.010 mol 0.010 mol
反应后剩余 Cl-:0.0200
mol-0.010 mol = 0.010 mol。其次 Ba2+ 与 SO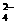 发生反应生成白色 BaSO4 沉淀:
发生反应生成白色 BaSO4 沉淀:
Ba2+ + SO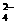 ==== BaSO4↓
==== BaSO4↓
23.(6分)1.5 g火箭燃料二甲基肼[(CH3)2N2H2]完全燃烧时放热50 kJ。求充分燃烧0.5 mol二甲基肼放出多少千焦热量?
22.(4分)已知石墨和金刚石燃烧化学方程式如下:
C(石墨s)+02(g)=C02(g)
C(金刚石s)+02(g)=CO2(g)
质量分别为12 g的石墨和金刚石在某一相同条件下燃烧时各自放出的热量为393.8 kJ和395.2 kJ,问:对于单质来说,稳定的单质是石墨还是金刚石? 简述理由。
21. (12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2
(g) + 3 H2(g) 2NH3(g)
(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2
(g) + 3 H2(g) 2NH3(g)
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =__________mol;
 (2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),
n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
20.(11分)在一定条件下的可逆反应,向容器中加入反应物
(1)反应刚开始时:反应物浓度 ,正反应速率 。生成物浓度 ,逆反应速率 。(填“最大”或 “最小” )
(2)反应进行中时:反应物浓度 ,正反应速率 。生成物浓度 ,逆反应速率 。(填“增大” 、“减少”或 “不变” )
(3)反应达到平衡后:反应物浓度 ,生成物浓度 (填“改变”或“不变” )。此时正反应速率与逆反应速率 。(填“相等”或“不相等” )
19.(4分)指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,(2)给手机的电池充电
(3)用畜电池点亮灯泡 ,(4)电解水得到O2和H2 。
⒘(5分)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它有煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式 ,该反应是 反应(填吸热、放热)。
(2)设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为C02和H2O,试比较完全燃烧等质量的C3H8及CO所需的氧气的质量比为: 。

18.(10分)如图所示装置: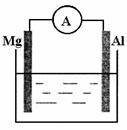
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。两极反应式为:正极 ; 负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
16. 某学生用右图1所示装置进行化学反应X+2Y==2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升。关于该反应的下列叙述①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。其中正确的是 ( )
 A、①②③ B、①③ C、①② D、①
A、①②③ B、①③ C、①② D、①
15. 在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过
程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A. 0.02 mol/(L•min) B.1.8mol/(L•min) C. 1.2 mol/(L•min) D.0.18 mol/(L•min)
14.
一定条件下反应N2(g)+3H2(g)
 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com