
题目列表(包括答案和解析)
1. 光纤通信是一种现代化的通信手段,它可以提供大容量、高速度、高质量的通信服务。目前,我国正在大力建设高质量的宽带光纤通信网络,即信息高速公路。光纤通信所使用的光缆,其主要部件为光导纤维。下列说法正确的是( )
①制造光导纤维的主要原料是CaCO3;②制造光导纤维的主要原料是SiO2;③光导纤维传递光信号的基本物理原理是光的全反射;④光导纤维传递光信号的基本物理原理是光的折射
A.①④ B.②③ C.①③ D.②④
4、用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
要点导悟
重难点一 碳和硅的比较
|
|
碳 |
硅 |
|||
|
原子结构示意图 |
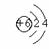 |
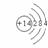 |
|||
|
物理性质 |
|
晶体硅是灰黑色、有金属光泽、硬而脆的固体。硅和锗是重要的半导体材料 |
|||
|
化学性质 |
在高温和点燃下有强还原性
2C + O2 2CO
C + O2 CO2 3C + Fe2O3
|
①加热条件下,能跟一些非金属单质起反应。 Si + O2 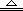 SiO2 SiO2
Si + 2H2  SiH4 SiH4②常温下,不能强酸、强氧化性酸反应,只能与氟气、氢氟酸(HF)和烧碱等物质反应。 Si + 2F2 == SiF4 Si + 4HF==SiF4 +H2↑ Si + 2NaOH + H2O == Na2SiO3 + 2H2↑ |
|||
|
工业制法 |
|
SiO2
+ 2C  Si + 2CO↑ Si + 2CO↑(焦炭在电炉中还原二氧化硅得到粗硅)粗硅提纯后,可以得到可用作半导体材料的高纯硅。 |
|||
|
用途 |
作还原剂、吸附剂 |
①作半导体材料晶体管、集成电路、硅整流器和太阳能电池等; ②制合金:含硅4%的钢具有良好的导磁性--变压器铁芯; 含硅15%左右的钢具有良好的耐酸性--耐酸设备等。 |
重难点二 SiO2与CO2的比较
|
|
CO2 |
SiO2 |
|
与碱性氧化物反应 |
CaO+CO2 CaCO3 CaCO3 |
CaO+SiO2  CaSiO3 CaSiO3 |
|
与碱液反应 |
2NaOH+CO2=Na2CO3+H2O |
SiO2+2NaOH =
Na2SiO3+H2O |
|
与盐反应 |
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
2Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ CaSiO3+CO2↑ |
|
与碳反应 |
C+CO2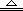 2CO 2CO |
2C+SiO2 Si+2CO↑ Si+2CO↑ |
|
与H2O作用 |
CO2+H2O  H2CO3 H2CO3 |
不与水化合 |
|
与酸反应 |
不反应 |
只与HF反应 SiO2+4HF=SiF4↑+H2O |
典型题解析
例、下列各单质和化合物之间有以下的转化关系,而且各单质和化合物组成的元素皆为短周期元素。
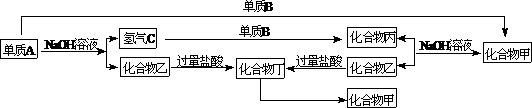 根据上述关系判断:
根据上述关系判断:
(1)单质A可能是_______,这是因为_______________。
(2)单质B一定是金属还是非金属________,这是因为___________________。
(3)各化合物的化学式为:甲________、乙________、丙________、丁________。
要点提示:本题是元素及化合物推断题,解题的突破口是短周期内元素的单质A与NaOH溶液反应生成氢气C的元素可能是Al和Si,而产生的化合物乙与过量盐酸溶液反应,生成的化合物丁能两次失去化合物丙生成化合物甲,则进一步推断出A单质不是金属Al,而只能是Si。又由于单质A和化合物甲都能跟NaOH溶液反应,都生成化合物乙(Na2SiO3),只不过A的另一种产物是氢气,而化合物甲的另一种产物为化合物丙,丙又可通过氢气与单质B反应生成,故单质B为O2,其它的各种化合物也就能推出来了。
答案: (1)硅Si;在短周期内,能与NaOH溶液反应放出氢气的只可能是铝和硅,但铝的氢氧化物可溶于过量盐酸中,不符合题意;故A只能是单质硅。(2)是非金属,硅只有和氧气反应,才能生成酸性氧化物(SiO2)与碱液(NaOH溶液)反应。(3)甲SiO2、乙Na2SiO3、丙H2O、丁H4SiO4。
练习
3、化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:
①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
③高温下与碱性氧化物反应:SiO2+CaO CaSiO3
CaSiO3
2、物理性质:熔点高,硬度大,不溶于水。
1、SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
4、硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑ Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl
3、用途:太阳能电池、计算机芯片以及半导体材料等。
2、化学性质:
①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4 Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
Si+O2 SiO2 Si+2Cl2
SiO2 Si+2Cl2 SiCl4
SiCl4
1、物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
12、(1)SiO2 (2)CO
高温
(3)C + H2O==CO + H2
点燃
(4)2H2 + O2 ==2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com