
题目列表(包括答案和解析)
6.A 比较反应速率时,应该用同一种反应物(或生成物)来进行比较。根据化学方程式中各物质
的计量关系将选项B.C.D中的反应速率都换算成为反应物A的反应速率可以发现,反应最快的
是A选项
5.B
4.B A与B做电极的原电池中B为负极,说明A比B活泼;与等浓度的盐酸反应D比A剧烈,
说明D比A活泼;铜与B的盐溶液不反应,说明B比铜活泼;铜能置换出C来,说明铜比C活
泼。综合以上情况,四种金属的活动性顺序为DABC,本题选B。
3. D
Zn、Cu和稀硫酸组成的原电池的总反应式为Zn+2H+=Zn2++H2↑,反应中Zn的质量减少,但Cu的质量没有增加,所以AB都不符合题目要求。Fe、Ag和AgNO3组成的原电池中,负极的电极反应式为Fe-2e-=Fe2+,质量减少;正极的电极反应式为2Ag++2e-=2Ag,质量增加,所以D是正确选项。
D
Zn、Cu和稀硫酸组成的原电池的总反应式为Zn+2H+=Zn2++H2↑,反应中Zn的质量减少,但Cu的质量没有增加,所以AB都不符合题目要求。Fe、Ag和AgNO3组成的原电池中,负极的电极反应式为Fe-2e-=Fe2+,质量减少;正极的电极反应式为2Ag++2e-=2Ag,质量增加,所以D是正确选项。
2.D 铜片和锌片用导线连接后插入稀硫酸中形成原电池,锌比铜活泼,在原电池中作负极。
1.B 改用浓硫酸,会使铁片表面被钝化从而不再与浓硫酸反应,而且浓硫酸具有强氧化性,与金
属反应不产生氢气。
15.A(气)+B(气)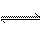 C(气)的平均反应速率为0.001 mol/(L·s),温度每升高10℃,反应速率增大到原来的3倍。计算当温度升高了50℃,在此条件下A和B反应进行10秒后,物质C的浓度为多少?
C(气)的平均反应速率为0.001 mol/(L·s),温度每升高10℃,反应速率增大到原来的3倍。计算当温度升高了50℃,在此条件下A和B反应进行10秒后,物质C的浓度为多少?
答案与解析
14.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用KOH溶液作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:(1)甲烷与氧气反应的化学方程式为: ;
 (2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
。
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
13.已知拆开1 mol H-H键、1 mol N≡N、1 mol N-H键分别需要吸收的能量为436kJ、946k J、391k J。则由氢气和氮气反应生成1 mol NH3需要 (填“放出”或“吸收”) mol的热量。
12.在空气中煅烧硫铁矿可以产生SO2和氧化铁。为了提高生产SO2的速度,下列措施可行的是( )
A、 把块状矿石碾成粉末
B、 增大O2压强,向炉内喷吹空气
C、 添加氧化铁作催化剂
D、 降低温度并降低SO2浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com