
题目列表(包括答案和解析)
6.下列有关周期表知识的叙述中正确的是 ( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素的族序数
B.除短周期外,其他周期均只有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
5.Z元素的某同位素离子Zn-,其核外共有X个电子,该同位素原子的质量数为A。则其原子核内含有的中子数为 ( )
A.A-X+n B.A-X-n C.A+X+n D.A+X-n
4.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.10克D2O(重水)中所含电子数为5NA
B.1molNa2O2中含有4NA个离子
C.在标准状况下,11.2LSO3所含原子的数目为4NA
D.100mL浓度为12mol/L的硝酸与足量的铜反应生成气体为NO2
3.下列各组物质中,互为同位素的是 ( )
A.石墨、金刚石 B.氕、氘 C.纯碱、烧碱 D.水、重水
2.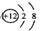 下列化学用语表达正确的是 ( )
下列化学用语表达正确的是 ( )
A.次氯酸的结构式:H-Cl-O B.Mg原子结构示意图:
C.碳-12 的原子符号: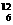 C D.过氧化氢的电子式H+ [:O:O:]2- H+
C D.过氧化氢的电子式H+ [:O:O:]2- H+
1.你认为减少酸雨产生的途径可采取的措施 ( )
①少用煤作燃料 ②把工厂烟囱造高
③燃料脱硫 ④在已酸化的土壤中加石灰
⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
24.(8分) 由等质量的铜片和银片和200mLAgNO3组成的原电池中,工作一段时间后,两极质量差为2.8g. 此时AgNO3恰好反应完。
(1)通过导线的电子的物质的量是多少?
(2)消耗铜的质量是多少?
(3)原AgNO3溶液的物质的量浓度是多少?
23.(7分)在一密闭的1L的容器里装有4mol SO2和2mol O2,在一定条件下开始反应。2min末测得容器中有3.6mol SO2,试计算:
(1)2min末SO3的浓度。 (2)2min内SO2的平均反应速率。
(3)O2的转化率。
22.(14分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可分解生成含Y的分子,则X的电子式为_______________,其分子含有_______
_(填“极性键”或“非极性键”或“极性键和非极性键” )。D与C形成的化合物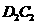 可与Y反应生成单质C,该反应的化学方程式为________________
____。
可与Y反应生成单质C,该反应的化学方程式为________________
____。
(2)E是金属元素,其单质既能与酸反应又能与碱反应,写出E单质与强碱反应的离子反应程式:____________________________ _。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成W气体(已知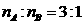 ),常温下W 气体极易溶于水的原因是________________
。
),常温下W 气体极易溶于水的原因是________________
。
(4)A的单质与C的单质在KOH的溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为____________________________________。
(5)在10L的密闭容器中,通入2mol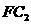 气体和3mol C的气体单质,一定条件下反应后生成
气体和3mol C的气体单质,一定条件下反应后生成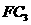 气体,当反应达到平衡时,单质C的浓度为
气体,当反应达到平衡时,单质C的浓度为 ,则平衡时
,则平衡时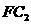 的转化率为________。
的转化率为________。
20. (14分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB能与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出这五种元素的名称:A ,B ,C ,D ,E
(2)画出E的原子结构示意图: ,写出电子式:
D2A ,EB4 。
(3)比较EA2与EB4的熔点高低(填化学式): > 。
(4)写出D单质与CuSO4溶液反应的离子方程式: 。
21(9分).将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(“锌”、“铜”),铜极发生的电极反应方程式是 ,该电池的总反应的离子方程式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上反应的电极反应方程式是 ,
该电池总反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com