
题目列表(包括答案和解析)
25.某探究小组利用丙酮的溴代反应(CH3COCH3+Br2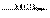 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
24.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
23.n mol H2与n mol T2气体不同之处是
A.质量 B.原子数 C.电子数 D.体积(相同状况)
22.(12分)下表给出了六种元素的相关信息,其中A、B、C、D、E为短周期元素。
|
元素 |
相 关 信 息 |
|
A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。K^S*5U.C |
|
B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
|
C |
植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝。 |
|
D |
室温下其单质呈淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
|
E |
它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂。 |
|
F |
它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等。 |
请根据以上信息回答问题:
(1)A元素符号 F元素的名称 。
(2)C元素在周期表中的位置 。
(3)D元素原子结构示意图 。
(4)E元素最高价氧化物对应水化物化学式为 。
(5)有A、B和E三种元素组成的化合物属于 晶体(填“原子”、“离子”或“分子”),其晶体中含有的化学键类型为 。
(6)B和D对应的气态氢化物中,稳定性强的是 ,熔沸点高的是 。(用具体的化学式表示)
(7)D的最高价含氧酸稀溶液与F单质反应的离子方程式 。
B卷(能力提高题 共50分)
21.(12分)下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
⑥ |
|
|
⑧ |
⑩ |
|
3 |
① |
③ |
⑤ |
|
⑦ |
|
⑨ |
|
|
4 |
② |
④ |
|
|
|
|
|
|
(1)这10种元素中,化学性质最不活泼的元素是 (写序号),得电子能力最强的原子是 (写元素符号),失电子能力最强的单质与水反应的化学方程式是
。K^S*5U.C
(2)元素④的离子结构示意图为 ;
(3)⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为: 、
(4)写出③的单质置换出⑥的单质的化学方程式
(5)①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:
20.(10分)根据组成原电池的条件,试以反应:Fe+Cu2+==Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。K^S*5U.C
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
19.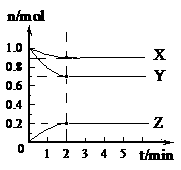 (6分)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请通过计算回答下列问题。K^S*5U.C
(6分)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请通过计算回答下列问题。K^S*5U.C
(1)反应开始至2 mim,Y的平均反应速率 。
(2)分析有关数据,写出X、Y、Z的反应方程式
。
18.(8分)(1)分析下列物体的物理性质,判断其晶体类型:
①碳化铝为黄色晶体,熔点为2200℃熔融态不导电。___________;
②五氟化钒为无色晶体,熔点为19.5℃,易溶于乙醇、氯仿、丙酮中。____________;
③溴化钾为无色晶体,熔融时或溶于水中都能导电。___________;
(2)从能量角度看,断开化学键要_________,形成化学键要___________。水的分解需要吸收热量,试从化学键变化的角度分析原因________________________________________,该反应△H___________0(填<,>)。K^S*5U.C
17.(4分)下列各组物质中:K^S*5U.C
 ③ CH3CH3 和CH3CH2CH2CH3 ④ H2和 T2
③ CH3CH3 和CH3CH2CH2CH3 ④ H2和 T2
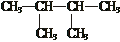 ⑤
⑤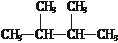 与
⑥ CH3-CH2-OH和CH3-O-CH3
与
⑥ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;____ __; 互为同素异形体是:____ __;
互为同分异构体是:___ ___; 互为同系物的是: 。
15.在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:
X(g) + 2Y(g) 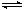 2Z(g)
此反应达到平衡的标志是K^S*5U.C
2Z(g)
此反应达到平衡的标志是K^S*5U.C
A.正反应和逆反应的速率都为零
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
|
A.Y的气态氢化物的稳定性较Z的强
B.原子半径:W>Z>Y>X
C.W的最高价氧化物对应水化物的酸性较Z的强
D.四种元素的单质中,Z的熔、沸点最高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com