
题目列表(包括答案和解析)
2.纯水导电能力极差,但加入了酸、碱、盐后,其导电能力却有了较大的提高,为什么?
思路解析:导电的前提是外电场及电场中有可自由移动的带电粒子,纯水的导电能力极差,说明其中没有或很少可自由移动的带电粒子。加入了酸、碱、盐后导电能力提高了,可能是溶液中已经有了可以自由移动的带电粒子。
答案:纯水中加入了酸、碱、盐后,体系中可能有了可自由移动的带电粒子。
1.对电解质的叙述正确的是( )
A.溶于水能导电的物质 B.熔融态能导电的物质
C.在水中能生成离子的物质 D.在溶液中或熔融状态下能离解为离子的化合物
思路解析:电解质是指在水溶液中或熔融状态下能导电的化合物,其实质是能电离。有些物质溶于水生成的化合物能导电,可是原物质不是电解质,如NH3、SO2等。单质既不是电解质也不是非电解质。
答案:D
10.铝可以从铝土矿中获取,铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如我们对铝的消费保持现有速度,我们能获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的。但是在废物回收过程中,仍有相当大的难度,其关键的因素主要涉及旧金属的收集与其他废物的分离、回收和提炼金属的费用、金属本身的价值等。
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电量(已知1 mol电子电量约为105C)?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
思路解析:(1)回收铝的过程中存在的困难是:①人们的环境意识薄弱;②回收和提炼金属的费用较高;③铝同其他废物的分离较困难;④铝本身价值并不高;⑤旧金属的收集缺乏专门的机构。
(2)因为金比铝的价值要高,另一方面,金活动性弱,容易回收。
(3)因为Fe2O3和SiO2与强碱都不反应,因此可把铝土矿溶于强碱溶液中,过滤除去杂质,即得到偏铝酸钠溶液,往滤液中加酸即可得氢氧化铝沉淀,由于氢氧化铝沉淀可和强酸反应,所以要得到较多的沉淀,最好加弱酸,方程式表示为:
①Al2O3+2NaOH====2NaAlO2+H2O
②NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3
③2Al(OH)3====Al2O3+3H2O
(4)这是一个涉及氧化还原反应的问题。氧化铝要被还原成单质铝,化合价必须从+3降低到0,即要得到1 mol Al必须转移3 mol的电子,所需电量为3×105 C。
(5)直接代入物理有关电能的计算公式,可得:2.7×106/27×3×105×6×10-3 kJ=1.8×108 kJ。
(6)根据电解方程:2Al2O3====4Al+3O2↑,每产生1 mol Al的同时生成0.75 mol O2,由于此状态是非标准状态,要求氧气的体积还要进行体积的转化。300×0.75 mol×22.4 L·mol-1/273=18.5 L。
(7)1×106/27×3×105×6×10-3/3 600×0.6=11 000(元)。
答案:(1)回收铝的过程中存在的困难是:①人们的环境意识薄弱;②回收和提炼金属的费用较高;③铝同其他废物的分离较困难;④铝本身价值并不高;⑤旧金属的收集缺乏专门的机构。(2)金比铝的价值要高,另一方面,金活动性弱,容易回收。(3)①Al2O3+2NaOH====2NaAlO2+H2O;②NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3;③2Al(OH)3====Al2O3+3H2O。(4)3×105 C (5)1.8×108 kJ (6)18.5 L (7)11 000元
9.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
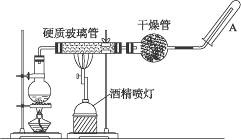
请完成该实验中的问题:
(1)写出该反应的反应方程式:__________________________________________________;
该氧化还原反应的还原剂是___________________,氧化剂是___________________。
(2)实验前必须对整套装置进行气密性检查,操作方法是____________________________。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________________________________。
(4)酒精灯和酒精喷灯点燃的顺序是_______________,为什么?_____________________。
(5)干燥管中盛装的物质是_______________,作用是_______________________________。
(6)试管中收集的气体是_______________。如果要在A处的玻璃管处点燃该气体,则必须对该气体进行______________________________,方法是______________________________,这一操作的目的是_______________________________________________________________。
答案:(1)3Fe+4H2O(g) Fe3O4+4H2↑
Fe H2O
Fe3O4+4H2↑
Fe H2O
(2)在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则表明该套装置气密性良好
(3)提供持续不断的水蒸气 防止暴沸事故的发生
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯 防止先点燃酒精喷灯导致Fe与O2的反应
(5)碱石灰干燥剂 除去反应产生的H2中混有的水蒸气
(6)H2 验纯 用试管收集一试管气体,靠近酒精灯火焰,如果发出爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气 防止点燃时,氢气因含有氧气而爆炸
8.不是由钠的化学性质决定的用途是( )
①制取过氧化钠 ②做原子反应堆的导热剂 ③冶炼钛 ④制高压钠灯
A.② B.①② C.③④ D.②④
思路解析:制取过氧化钠是钠和氧气的反应,冶炼钛是钠将钛还原,这些是钠的化学性质的运用;做原子反应堆的导热剂和制高压钠灯是利用钠的物理性质。
答案:D
7.在烧杯中加入水和苯(密度0.97 g·cm-3)各50 mL。将一小粒金属钠(密度0.97 g·cm-3)投入烧杯中,观察到的现象可能是( )
A.钠在水层中反应并上下游动 B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并上下游动 D.钠在苯与水的界面处反应并上下游动
思路解析:根据钠与水和苯三者的密度可以判定:钠应在水层和苯层之间,但钠与水反应产生的氢气,使钠粒获得反作用力,故而会在界面处上下游动。
答案:D
6.取一小块金属钠放在燃烧匙里加热,下列实验现象:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质。描述正确的是( )
A.①② B.①②③ C.①④⑤ D.④⑤
思路解析:钠在燃烧匙中燃烧,生成的是浅黄色的过氧化钠,由于其熔点低,所以首先熔化成小球,燃烧时的火焰为黄色。
答案:C
5.下列物质露置在空气中,质量会减轻的是( )
A.NaOH B.Na2O2 C.无水CaCl2 D.Na2CO3·10H2O
思路解析:NaOH能吸收空气中的二氧化碳和水使其质量增加;Na2O2在空气中吸收水和二氧化碳,放出氧气,最终也会转化为Na2CO3,质量也会增加;无水CaCl2在空气中吸收水(潮解),质量增加;Na2CO3·10H2O在空气中容易失水(风化),造成质量减小。
答案:D
4.由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),那么此合金中一定含有的金属是( )
A.Na B.Mg C.Al D.Zn
思路解析:依题意,当产生H2 22.4 L即1 mol时,消耗合金的质量为48 g。产生1 mol H2,所消耗的Na、Mg、Al质量分别为46 g、24 g、18 g,均小于48 g。根据平均值原理,必有一种金属的摩尔质量大于48 g·mol-1。只有Zn符合要求。所以,该合金中必含有Zn。
答案:D
3.除去镁粉中混有的少量铝粉,可选用的溶液是( )
A.盐酸 B.硝酸 C.氨水 D.氢氧化钾
思路解析:Mg不与强碱溶液发生反应,而铝可以与强碱溶液发生反应,铝与氢氧化钾反应的方程式为2Al+2KOH+2H2O====2KAlO2+3H2↑。故选D。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com