
题目列表(包括答案和解析)
10.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A.Al3+ B.Mg2+ C.Be2+ D.H+
解析:Al3+、Mg2+核外电子层数都为2,Be2+核外电子层数为1,H+核外电子层数为0,故B正确。
答案:B
9.甲、乙是周期表中同一周期的两种元素,甲在ⅡA族,乙在ⅢA族,那么甲、乙两元素的原子序数之差不可能是( )
A.1 B.11 C.25 D.10
解析:甲、乙两元素同在第二、第三周期时,原子序数之差为1;同在第四、第五周期时原子序数之差为10;同在第六、第七周期时,原子序数之差为25,所以不可能为11。
答案:B
8.我国自行安装的秦山核电站所用的燃料为铀235的氧化物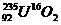 ,下列与之有关的说法正确的是( )
,下列与之有关的说法正确的是( )
A.1 mol此氧化物中含质子100 mol
B.铀的相对原子质量为235
C.U-235与U-238属于同一种核素
D.1 mol 此氧化物所含中子数是阿伏加德罗常数的159倍
解析:本题是一道综合性较强的题目,涉及的概念较多。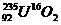 表示UO2这种氧化物含有
表示UO2这种氧化物含有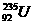 和
和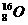 两种核素。U-235与U-238属于同位素,是铀元素的两种不同核素。相对原子质量分为元素的相对质量和原子的相对原子质量,显然
两种核素。U-235与U-238属于同位素,是铀元素的两种不同核素。相对原子质量分为元素的相对质量和原子的相对原子质量,显然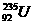 的质量数并不代表铀元素的相对原子质量。1 mol
的质量数并不代表铀元素的相对原子质量。1 mol 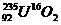 所含的质子数应为108,含中子数为159,选D。
所含的质子数应为108,含中子数为159,选D。
答案:D
7.根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组粒子结构不相似的是( )
A.CO和N2
B.O3和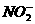
C.CO2和N2O D.N2H4和C2H4
解析:上述各物质的电子数分别是CO:14、N2:14;O3:24、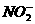 :24;CO2:22、N2O:22;N2H4:18、C2H4:16,所以不是等电子体的是D选项。
:24;CO2:22、N2O:22;N2H4:18、C2H4:16,所以不是等电子体的是D选项。
答案:D
6.地球上的海水中蕴藏了大约40万亿吨氘。从1升海水里提取的氘,在聚变反应中所释放的能量,相当于燃烧300升汽油。如果把自然界的氘和氚全部用于聚变反应,释放出来的能量足够人类使用100亿年。与核裂变相比,氘和氚的聚变能是一种安全、不产生放射性物质、原料成本低廉的能源。同温同压下有等质量的H2、D2、T2三种气体,下列叙述正确的是( )
①密度之比为1∶2∶3 ②质子数之比为6∶3∶2 ③中子数之比为0∶6∶8 ④体积之比为6∶3∶2
A.①②③④ B.只有①② C.只有③④ D.只有②④
解析:H2、D2、T2三种气体的式量分别为2、4、6,根据阿伏加德罗定律:同温同压下,气体的密度之比等于其相对分子质量(式量)之比,故①正确。其他选项,可设定三种气体的质量均为12 g,则②质子数之比为6∶3∶2。③中子数之比为:6mol×0×NA∶3mol×2NA∶2mol×4NA=0∶6∶8,③正确。④体积之比为:V(H2)∶V(D2)∶V(T2)=n(H2)∶n(D2)∶n(T2)=6∶3∶2,④正确。
答案:A
5.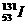 是人工合成的,常用于医疗上作放射性诊断。下列有关说法不正确的是( )
是人工合成的,常用于医疗上作放射性诊断。下列有关说法不正确的是( )
A.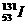 在元素周期表中位于ⅦA族
在元素周期表中位于ⅦA族
B.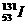 的半径比
的半径比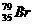 的大
的大
C.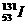 的质子数是53
的质子数是53
D.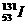 与
与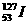 物理性质和化学性质相同
物理性质和化学性质相同
解析:A项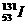 是碘元素的一种核素,与碘元素的其他核素一起都位于元素周期表的ⅦA族的同一位置上。B项
是碘元素的一种核素,与碘元素的其他核素一起都位于元素周期表的ⅦA族的同一位置上。B项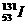 与其同位素有相同的核电荷数和电子数,而原子半径主要由核电荷数和核外电子数决定,所以
与其同位素有相同的核电荷数和电子数,而原子半径主要由核电荷数和核外电子数决定,所以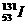 的半径大于
的半径大于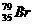 的原子半径。C项
的原子半径。C项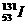 的质子数=核外电子数=荷电核数=53。D项
的质子数=核外电子数=荷电核数=53。D项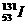 与
与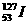 互为同位素,同位素的化学性质相同,但物理性质不完全相同。
互为同位素,同位素的化学性质相同,但物理性质不完全相同。
答案:D
4.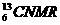 (核磁共振)可用于含碳化合物的结构分析,
(核磁共振)可用于含碳化合物的结构分析,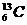 表示的碳原子( )
表示的碳原子( )
A.核外有13个电子,其中6个参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
解析:解本题的关键是:①理解符号 的含义,A代表质量数,Z代表质子数;②理清几个量之间的关系,质子数=核电荷数=核外电子数=原子序数,质量数=质子数+中子数。
的含义,A代表质量数,Z代表质子数;②理清几个量之间的关系,质子数=核电荷数=核外电子数=原子序数,质量数=质子数+中子数。
该题中的碳原子,其质量数=13,质子数=核电荷数=核外电子数=原子序数=6,中子数=质量数-质子数=13-6=7,又因为主族元素原子最外层的电子才参与成键,根据碳原子核外电子的排布情况可知,它只有4个电子能参与成键。
答案:D
3.在元素周期表中,第三、四、五、六周期元素的数目分别是( )
A.8、18、32、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
解析:此题主要考查核外电子的排布规律和元素周期表的结构。
答案:B
2.“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在不远的将来中国人将会登上月球。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一。以下叙述正确的是( )
A.由质量数为3的氦原子构成的分子是双原子分子
B.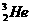 与
与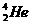 的性质均相同
的性质均相同
C.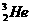 、
、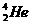 形成的分子中存在共价键
形成的分子中存在共价键
D.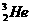 中的质子数与
中的质子数与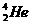 的中子数相等
的中子数相等
解析:A项中由质量数为3的氦原子构成的分子仍然是单原子分子;B项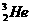 与
与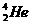 的化学性质相同,物理性质不同;C项
的化学性质相同,物理性质不同;C项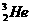 、
、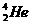 形成的分子为单原子分子,分子中不存在共价键。
形成的分子为单原子分子,分子中不存在共价键。
答案:D
1.下列各组物质中,互为同位素的是( )
A.重氢、超重氢 B.氧、臭氧
C.红磷、白磷 D.H2O、D2O
解析:同位素是指质子数相同,中子数不同的同一类原子的互称,所以,同位素首先必须是原子,因此,B、C、D项都不是。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com