
题目列表(包括答案和解析)
1.(2010·三亚高一检测)区别乙醇、苯和四氯化碳,最简单的方法是( )
A.加酸性高锰酸钾溶液后 振荡,静置
振荡,静置
B.与乙酸在有浓硫酸存在的条件下加热
C.加蒸馏水后振荡,静置
D.加硝酸银溶液后振荡,静置
[解析]选C。乙醇可与水混溶,加水后液体不分层;苯、CCl4不溶于水,加入水后液体分层,苯和CCl4的密度分别小于水和大于水,可以区分,故选C。
8.(9分)乙二酸(HOOC-COOH)俗称草酸。日常生活中的菠菜和豆腐不能同吃,因两者相互作用生成难溶于水的草酸钙,从而降低钙质的吸收效率。乙二酸的物理常数如下:

注:表中“--”是尚未有具体数据。
回答下列问题:
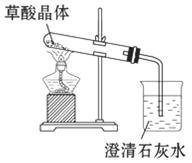 (1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为_________________________;说明乙二酸的酸性比碳酸________。
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为_________________________;说明乙二酸的酸性比碳酸________。
(2)已知草酸分解的化学方程式为
H2C2O4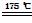 H2O↑+CO2↑+CO↑。
H2O↑+CO2↑+CO↑。
为了验证草酸受热分解及其产物,
用如图装置进行实验,加热草酸晶
体,有人认为该装置不合理。
请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的四个不合理之处:
① ________________ ;② ________________ ;
③ ________________ ;④ ________________ 。
(3)已知酸性乙二酸>碳酸>H2SiO3,请设计实验方案证明(画图说明)。
[解析](1)固体粉末逐渐溶解,同时在固体周围有少量气泡冒出,根据“强酸制弱酸”规律可知,其酸性比碳酸强。
(2)①科学性欠妥:草酸晶体的熔点低,未分解之前就已熔化并流到试管口处,不能完成分解实验;②在未洗气(除杂)的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成了草酸钙沉淀[HOOC-COOH+Ca(OH)2
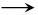 Ca(COO)2↓+2H2O],对鉴别产物CO2有干扰;③安全性欠妥:CO有毒,生成的CO未能除去,直接排放到大气中会造成环境污染及人身伤害;④可行性欠妥:本实验要证明草酸分解的所有产物,而本实验方案只设计证明了产物CO2,草酸晶体含有结晶水,加热后无法证明草酸的分解产物中是否含水。
Ca(COO)2↓+2H2O],对鉴别产物CO2有干扰;③安全性欠妥:CO有毒,生成的CO未能除去,直接排放到大气中会造成环境污染及人身伤害;④可行性欠妥:本实验要证明草酸分解的所有产物,而本实验方案只设计证明了产物CO2,草酸晶体含有结晶水,加热后无法证明草酸的分解产物中是否含水。
(3)利用较强酸制较弱酸的原理,将乙二酸加入Na2CO3溶液中制得CO2,再通入Na2SiO3溶液中制得H2SiO3,即可证明酸性:乙二酸>H2CO3>H2SiO3。
答案:(1)固体粉末逐渐溶解,同时在固体周围有少量气泡冒出 强
(2)①草酸晶体的熔点低,未分解即已流入到试管口处
②未洗气而通入石灰水,可生成草酸钙沉淀而对产物CO2有干扰
③CO有毒,没有除CO装置
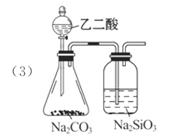 ④没有设计鉴别含有结晶水的装置
④没有设计鉴别含有结晶水的装置
7.(11分)(思维拓展题)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取 乙酸乙酯的装置,较合理的是_______(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_________________________________________。
乙酸乙酯的装置,较合理的是_______(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_________________________________________。
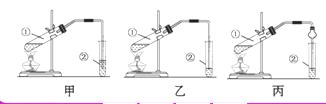
[实验步骤](1)按所选择的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸; (2)将试管固定在铁架
(2)将试管固定在铁架
台上;(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]a.步骤(1)装好实验装置,加入药品前还应检查__________ ;
b.写出试管①发生反应的化学方程式(注明反应条件)
___________________________________________ ;
c.试管②中饱和Na2CO3溶液的作用是________________
___________________________________________;
d.从试管②中分离出乙酸乙酯的实验操作是_________。
[解析]乙装置比甲装置合理,因为甲装置将导管末端插入到液面以下,容易引起液体倒吸。将甲中的玻璃管改成球形干燥管,能起到防倒吸作用。装药品之 前要先检查装置气密性。反应方程式为
前要先检查装置气密性。反应方程式为
CH3COOH+C2H5OH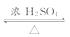 CH3COOC2H5+H2O。饱和Na2CO3
CH3COOC2H5+H2O。饱和Na2CO3
溶液的作用是吸收乙醇,除去乙酸,降低乙酸乙酯的溶解
度,使其分层。由于乙酸乙酯不溶于饱和Na2CO3溶液,且密度比Na2CO3溶液小,故用分液方法进行分离。
答案:[装置设计]乙 能防止倒吸
[问题讨论]a.装置的气密性
b.CH3COOH+C2H5OH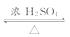 CH3COOC2H5+H2O
CH3COOC2H5+H2O
c.吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分
层 d.分液
[实验·探究]
6.(10分)苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为:
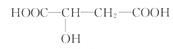
(1)苹果醋中含有的官能团的名称是______、 ______;
(2)苹果醋的分子式为_______;
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气_______ L;
(4)苹果醋可能发生的反应是_______ ;
A.与NaOH溶液反应
B.与石蕊溶液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化
[解析]苹果醋中含有2个-COOH和1个-OH,都可以与Na反应产生H2,故1 mol ACV与足量钠反应可产生H2 1.5 mol。它含有-COOH可与石蕊溶液作用,可与NaOH、乙醇反应。它含有-OH可与乙酸发生酯化反应。
答案:(1)羟基 羧基 (2)C4H6O5
(3)33.6 (4)A、B、C、D
5.用30 g乙酸与46 g乙醇反应,如果实际产率是理论产率的80%,则可得到的乙酸乙酯的质量是( )
A.29.5
g B.44 g
C.68 g D.35. 2 g
2 g
[解析]选D。发生反应时乙醇过量,设理论生成乙酸乙酯的质量为x。
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
60 88
30 g x
x=44 g,因实际产率是理论产率的80%,则可得乙酸乙酯质量为44 g×80%=35.2 g。
4.已知乙醇分子中羟基上的氧原子是18O,则它与乙酸反应生成的酯的相对分子质量是( )
A.126 B.104 C.90 D.88

2.(2010·九江高一检测)下列反应属于取代反应的是( )
A.乙酸与活泼金属反应
B.乙醇与乙酸反应生成乙酸乙酯
C.乙醇与氧气反应生成乙醛
D.乙醇在空气中燃烧
[解析]选B。A项为置换反应,B项为取代反应,C项为氧化反应,D项为氧化反应。

1.下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应是不可逆反应
 [解析]选D。生活常用调味品白酒和食醋的主要成分分别为乙醇和乙酸,A项正确;乙酸和乙醇常温下为液体,而乙烷和乙烯为气体,故B项正确;乙醇被氧化为乙酸,乙酸燃烧生成二氧化碳和水均属于氧化反应,C项正确;酯化反应是可逆反应,D项错误。
[解析]选D。生活常用调味品白酒和食醋的主要成分分别为乙醇和乙酸,A项正确;乙酸和乙醇常温下为液体,而乙烷和乙烯为气体,故B项正确;乙醇被氧化为乙酸,乙酸燃烧生成二氧化碳和水均属于氧化反应,C项正确;酯化反应是可逆反应,D项错误。
8.(12分)化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。
在250 mL圆底烧瓶中依次加入2 g氢氧化钠、100 mL蒸馏水、2 g葡萄糖(粉末),振荡使其溶解。滴入4-6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色
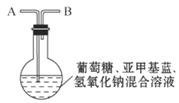 消失,变为无色。再次振荡,
消失,变为无色。再次振荡,
无色溶液又呈蓝色。可反复多
次。为探究是什么原因引起的,
有人做了以下实验。
Ⅰ.从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
Ⅱ.在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
Ⅲ.为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2,都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论。
(1)请总结“蓝瓶子”实验的变色原理:____________
__________________________________________。
(2)该实验中现象能否无限次重复进行_____(填“能”或“不能”)。理由是___________________________
______________________________________。
[解析]混合物中加入亚甲 基蓝溶液后,静置约3分钟后蓝色消失变为无色,说明亚甲基蓝跟混合物中的某种成分反应生成无色物质。再鼓入空气,又慢慢变蓝了,而改通纯净的N2、CO2都不能使烧瓶中的无色溶液变蓝,改通氧气变蓝色,说明是空气中的氧气将无色物质又氧化成亚甲基蓝,则亚甲基蓝褪色则是发生了还原反应,葡萄糖具有还原性。所以先是亚甲基蓝被葡萄糖还原成无色物质,无色物质又被空气中的氧气氧化成亚甲基蓝,然后亚甲基蓝被过量的葡萄糖还
基蓝溶液后,静置约3分钟后蓝色消失变为无色,说明亚甲基蓝跟混合物中的某种成分反应生成无色物质。再鼓入空气,又慢慢变蓝了,而改通纯净的N2、CO2都不能使烧瓶中的无色溶液变蓝,改通氧气变蓝色,说明是空气中的氧气将无色物质又氧化成亚甲基蓝,则亚甲基蓝褪色则是发生了还原反应,葡萄糖具有还原性。所以先是亚甲基蓝被葡萄糖还原成无色物质,无色物质又被空气中的氧气氧化成亚甲基蓝,然后亚甲基蓝被过量的葡萄糖还 原成无色物质,如此反复进行,直到葡萄糖被完全氧化为止。
原成无色物质,如此反复进行,直到葡萄糖被完全氧化为止。
答案:(1)首先亚甲基蓝被葡萄糖还原,还原后的无色物质又被空气中的氧气氧化,又成为亚甲基蓝,反复作用
(2)不能一段时间后葡萄糖全部转化为其他物质
7.(12分)燃料乙醇的生产过程可由图表示:
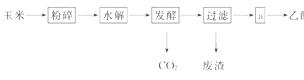
(1)粉碎玉米的目的是_____________________。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是_____________________。
(3)步骤a的操作是________。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:________。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示: 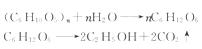
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇________ kg。
[解析](1)固体物质粉碎成粉状其表面积大大增加,参加反应的速率会加快。
(2) 注意是含碘单质(I2)的溶液,而非化合态碘。
注意是含碘单质(I2)的溶液,而非化合态碘。
(3)互溶而沸点不同的液体的分离用蒸馏的方法。
(5)由两个反应的化学方程式可知:
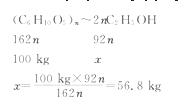
答案:(1)增大反应物的接触面积或加快反应速率或使反应充分进行 (2)碘(I2)或碘酒
(3)C (4)饮料、干冰、纯碱、碳酸钙(其他碳酸盐或碳酸氢盐)等中任选2个 (5)56.8
[实验·探究]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com