
题目列表(包括答案和解析)
8.(11分)煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式_____ 。
②以下是对硝酸型酸雨的评价,其中正确的是_____(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统;
b.对电线、铁轨、桥梁、房屋等均会造成严重损害;
c.破坏臭氧空洞;
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)下图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_____ 。
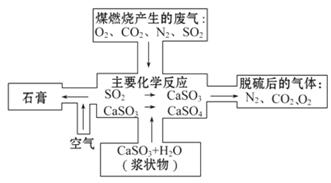
(3)脱硫以后,在废气中含量明显增加的不良气体是_____ (写物质名称),它对环境的负面影响是_____。
(4)检验脱硫后废气中是否含有SO2的简单方法是____。
[解析] (1)形成硝酸型酸雨,这说明煤燃烧生成NO和NO2等氮氧化物,NO跟O2反应生成NO2,NO2跟H2O反应生成HNO3。硝酸型酸雨有它的危害性,但它所含有的氮元素又是植物所需要的主要肥料之一。因此应该一分为二地评价酸雨的利与弊。这里不是对NO和NO2的评价,而是对硝酸型酸雨的评价,该酸雨对臭氧层没有破坏作用。
(2)由图 可知,脱硫是硫元素转化为CaSO4,最终产品是CaSO4·2H2O。
可知,脱硫是硫元素转化为CaSO4,最终产品是CaSO4·2H2O。
(3)通过问题(2)的解答可知,在脱硫的同时生成了CO2,并且CO2与SO2以等物质的量代换。
(4)检验SO2的高效试剂是品红溶液,并且这里没有干扰因素。
答案:(1)①2NO+O2====2NO2,
3NO2+H2O====2HNO3+NO ②a、b、d
(2)CaCO3+SO2====CaSO3+CO2,
2CaSO3+O2====2CaSO4,
CaSO4+2H2O====CaSO4·2H2O
(3)二氧化碳 使“温室效应”加剧,导致全球气候变暖
(4)将气体通入品红溶液观察品红是否褪色,品红褪色,说明废气中还含有SO2;品红不褪色,说明废气中不含SO2
7.(9分)根据下图所示回答下列问题:
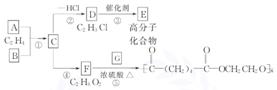
?(1)写出A、E、G的结构简式:
A _____ ,E _____ ,G _____ 。
(2)反应①的化学方程式是_____ ,
反应③的化学方程式是_____.
(3)写出①、④的反应类型:① _____ ,④ _____ 。
[解析]根据框图中D、F的分子式知,D分子中含有碳碳双键,结构简式为CH2==CHCl;F分子是饱和的,结构简式为HOCH2-CH2OH,逆推得C的结构简式为CH2ClCH2Cl,B为氯气。由C、F的结构简式可以判断,反应④为取代反应。D发生加聚反应生成E,E为聚氯乙烯。F与G在浓硫酸作用下加热发生缩聚反应,据所得产物的结构简式可知G为
HOOCCH2CH2CH2CH2COOH。
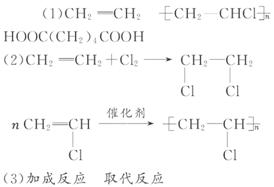 答案:
答案:
[实验·探究]
6.(10分)下图是实验室干馏煤的装置图:
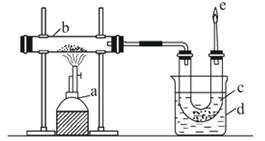
(1)指出图中仪器名称:a _____ ,d _____ 。
(2)仪器d的作用是_____ ,c中液体有____和_____ ,其中无机物里溶有_____ ,可用_____检验出来。有机物可以通过_____的方法使其中的重要成分分离出来。
(3)e处点燃的气体主要成分有_____ ,火焰的颜色是
_____ 。
[解析]本题是关于煤干馏的实验,根据煤干馏的主要产品,b中得到的应是焦炭,c中得到的应是粗氨水和煤焦油,e处点燃的应是焦炉气。其中粗氨水中溶有氨,呈碱性,可用酚酞溶液等检验;煤焦油主要是苯、甲苯、二甲苯的混合物,应用分馏的方法分离;焦炉气的主要成分有H2、CH4、CH2==CH2、CO,燃烧时呈淡蓝色火焰。
答案:(1)酒精喷灯 烧杯
(2)盛装冷水对蒸气进行冷却 粗氨水 煤焦油 氨酚酞溶液等 分馏
(3)H2、CH4、CH2==CH2、CO 淡蓝色
5.某高分子化合物的部分结构如下,下列说法不正确的是( )
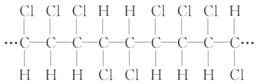
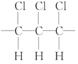
A.聚合物的链节是
B.聚合物的分子式为(C2H2Cl2)n
C.聚合物的单体是CHCl==CHCl
D.若n为聚合度,则其相对分子质量为97n
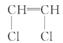 [解析]选A。因为单键可以旋转,故分子中氯原子在上方
[解析]选A。因为单键可以旋转,故分子中氯原子在上方
或在下方一样,该分子为加聚产物,其单体为 ,
链节 为 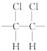 n为聚合度,相对分子质量为97n。
n为聚合度,相对分子质量为97n。
4.(2010·三明高一检测)下列说法正确的是( )
A.石油分馏获得的汽油是纯净物
B.石油的裂化是物理变化
C.煤干馏后可以得到粗苯
D.石油的裂解可以得到氯乙烯
[解析]选C。分馏是利用物质沸点不同来分离液体物质的方法,石油分馏时得到的每一种馏分仍为混合物,A错误;石油裂化是指在一定条件下将含碳原子数较多,相对分子质量较大的烃断裂为含碳原子数较少,相对分子质量较少的烃的过程,属化学变化,B错误;煤干馏可以得到粗苯、煤焦油等物质,C正确;石油是烃类物质的混合物,裂解产物仍然为烃,不会生成氯乙烯,D错误。
3.下列做法中不符合“绿色化学”思想的是( )
)
A.以水性涂料代替油性涂料
B.以无磷洗涤剂代替含磷洗涤剂
C.实验后的有毒有害物质应分类收集、统一处理
D.在通风橱中制氯气时不用NaOH溶液吸收尾气
[解析]选D。油性涂料中含有有机溶剂,其挥发会造成大气污染。磷元素是营养元素,大量使用含磷洗涤剂会造成赤潮等水污染。有毒有害物质分类收集、统一处理,能够减少污染。在通风橱中制取Cl2,尾气不用NaOH溶液处理,会逸散到大气中造成大气污染。
2.(2010·福州高一检测)绿色能源是指使用不会对环境造成污染和破坏的能源,下列属于绿色能源的是( )
A.煤 B.太阳能 C.木材 D.石油
[解析]选B。木 材燃烧会产生CO2,煤、石油燃烧不仅产生CO2,还会产生大气污染物,太阳能属于可再生能源且无污染,故选B。
材燃烧会产生CO2,煤、石油燃烧不仅产生CO2,还会产生大气污染物,太阳能属于可再生能源且无污染,故选B。
1.(多选)下列说法中正确的是( )
A.煤属于有机化合物
B.在物质变化类型上,煤的干馏过程包含了物理变化和化学变化
C.煤中含有大量的苯等芳香烃,煤是芳香烃的主要来源
D.煤的气化和液化属于煤的综合利用
[解析]选B、D。煤是由无机物和有机物组成的混合物。煤不直接含有芳香烃,在煤的干馏过程中生成了芳香烃。
7.(16分)利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+ =====Fe2+ +H2↑。
(2)实验用品:电极(_____、 _____)、稀硫酸、 _____(填写所缺的实验用品)、耳机(或者电流计)
(3)实验装置: 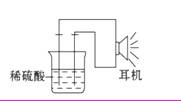
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为_____________。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的___极,电极反应是__________;另一极应该接电流计的___极,电极发生了___________反应。
[解析]从实验原理:Fe+2H+ ====Fe2+ +H2↑可知,Fe做原电池的负极,其电极反应是:Fe-2e- ====Fe2+,酸做电解质溶液,则比铁不活泼的金属或石墨做原电池的正极,其电极反应是:2H+ +2e- ====H2↑,在其工作过程中将化学能转化为电能。
答案:(2)铁钉或铁条 铜钉(其他的惰性电极如铅笔芯、铂等都正确) 烧杯、导线
(4)①电能 ②负 Fe-2e- ====Fe2+ 正 还原
6.(14分)(2009·海南高考)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2====
4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为______,发生的电极反应为________________;
(2)电池正极发生的电极反应为_________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是_______________________________________,
反应的化学方程式为_____________________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是_______________________________________。
[解析]分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂。
(1)负极材料为Li(还原剂):Li-e- =====Li+。
(2)正极反应式可由总反应式减去负极反应式得到:2SOCl2+4e- ====4Cl- +S+SO2。
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气味气体生成。
(4)电池中的Li能和氧气、水反应,且SOCl2也与水反应。
答案:(1)Li Li-e- ====Li+
(2)2SOCl2+4e- =====4Cl- +S+SO2
(3)出现白雾,有刺激性气味气体生成
SOCl2+H2O=====SO2↑+2HCl↑
(4)构成电池的主要成分Li能和氧气、水反应,且SOCl2也与水反应
[实验·探究]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com