
题目列表(包括答案和解析)
5.可逆反应2A(g)+3B(g)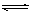 2C(g)+D(g)在四种不同条件下的反应速率分别为
2C(g)+D(g)在四种不同条件下的反应速率分别为
①υ(A)=0.5 mol·(L·min) ━1 ②υ(B)=0.6 mol·(L·min) ━1
③υ(C)=0.35 mol·(L·min) ━1 ④υ(D)=0.4 mol·(L·min) ━1
该反应在各条件下反应速率最快的是
A.① B.② C.③ D.④
4.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了
深入研究。下列关于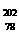 Pt的说法正确的是
Pt的说法正确的是
A.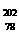 Pt和
Pt和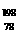 Pt是同一种核素
B.
Pt是同一种核素
B.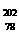 Pt和
Pt和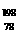 Pt互称为同位素
Pt互称为同位素
C.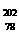 Pt和
Pt和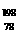 Pt的性质完全相同
D.
Pt的性质完全相同
D.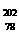 Pt和
Pt和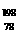 Pt互称为同分异构体
Pt互称为同分异构体
3.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的
晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。
则下列有关说法不正确的是
A.高聚氮晶体属于分子晶体 B.高聚氮转化为N2是化学变化
C.高聚氮是N2的一种同素异形体 D.做炸药或高能材料可能是高聚氮潜在的应用
2.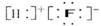
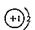 下列化学用语的表示中,正确的是
下列化学用语的表示中,正确的是
A.氢负离子(H-)结构示意图 B.HF的电子式
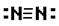
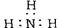
C.氮气的结构式: 了解到 D.NH3的电子式
1.近百年间,全球平均气温升高了0.74℃,预计到本世纪末全球气温将升高1.1-6.4℃。
下列做法可以减缓全球气温升高的是
①大力进行植树造林
②以煤等燃料为主要生活燃料
③鼓励私人购买和使用小汽车以代替公交车
④利用太阳能、风能和氢能等新能源代替化石燃料
⑤禁止电动自行车上路
A.①③④ B.②⑤ C.①④ D.②③⑤
33.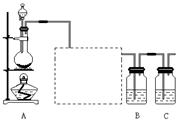 (11分,每空1分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(11分,每空1分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中的化学反应方程式 。
(2)画出虚线框内的实验装置图,所加试剂为 ,装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,
该反应的离子方程式是 ,
该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦ C.①②④⑤⑥ D.除 ①以外
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式 。
32.(15分,每空1分)化学反应与能量有比不可分的关系,回答下列问题。
Ⅰ:已知31g白磷变为31g红磷释放能量。试回答: ⑴上述变化属于____________(填“物理”或“化学”)变化。 ⑵31g白磷具有的能量_ _(“>”或“<”)31g红磷具有的能量,常温常压下, 更稳定。 ⑶31g白磷完全燃烧释放的能量__ (“>”或“<”)31g红磷完全燃烧释放的能量。 Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
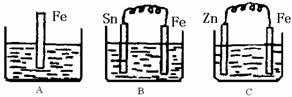
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A ;B ;C 。
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为: (填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 (填写序号)。
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
 (1)该反应的化学方程式为
。
(1)该反应的化学方程式为
。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。
31.(14分,每空1分)下表是元素周期表的一部分,回答下列有关问题:
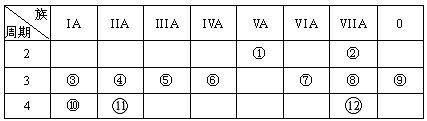
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ ;
(3)在①~12元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素名称)
(4)元素3、10、11的氢氧化物碱性由强到弱的顺序 ;元素6、7、8的氢化物稳定性由弱到强的顺序 (均用化学式填空)
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应: ;
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:
。写出能验证⑦的非金属性强于A的化学反应的离子方程式: 。
30.下列叙述不正确的是:
A.干冰变为二氧化碳气体,需吸收能量,是因为共价键被破坏
B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键
C.化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
D.共价化合物中一定只含共价键
Ⅱ卷
29.下列叙述中,甲金属一定比乙金属活泼性强的是:
A.甲原子最外层电子数为1,乙原子最外层电子数为2
B.在甲乙两种金属和盐酸构成的原电池中,甲表面有气泡生成
C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com