
题目列表(包括答案和解析)
5、下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量
B.凡经加热而发生的化学反应都是吸热反应
C.测定中和热的实验中每次实验需要测定三次温度数据
D.反应物的总能量高于生成物的总能量时,发生吸热反应;应物的总能量低于生成物的总能量时,发生放热反应
4、电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池是将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
3、下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是( )
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
2、用NA表示阿伏加德罗常数,下列说法中正确的组合为 ( )
①18gD2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含NA个电子 ⑦1molNa2O2与水完全反应时转移电子数为2NA
A.③⑤⑥⑦ B.③⑤⑥ C.①②④⑦ D.③④⑤⑥
1、北京时间2011年3月11日13时46分日本发生里氏9.0级大地震。地震导致的核泄露产生的放射性污染的主要成份是碘131和铯137,下列有关它们的说法正确的是( )
A.碘131的质子数是55,铯137的质量数是137
B.铯是金属性最强的元素,碘是非金属性最强的元素
C.碘元素在自然界有碘127和碘131两种稳定的同位素
D.铯137原子核内含有82个中子
30.(8分)钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l) NaCl(l)+K(g)(正反应吸热)
NaCl(l)+K(g)(正反应吸热)
|
压强(kPa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Ka的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
|
|
1437 |
|
NaCl的沸点(℃) |
|
|
1465 |
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
杭十四中二〇一〇学年第二学期阶段性测试
29.(12分)双氧水(H2O2)和水都是极弱的电解质。 (1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式 。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: 。
(3)水电离生成H3O+和OH-叫做水的自偶电离。双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为 。
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式 。
28.(6分)在温度为830°K时,下列可逆反应具有某些特殊性质:CO+H2O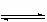 H2+CO2
若起始浓度[CO]为2mol/L、[H2O]=3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
设830°K时,起始浓度c(CO)为amol/L、c(H2O)为bmol/L,反应达到平衡时c(H2)为cmol/L。
(1)当b不变时,a减少,重新达到平衡时,CO的转化率 ,H2O的转化率 (填“上升”、“下降”或“不变”)
(2)当a=5,c=
H2+CO2
若起始浓度[CO]为2mol/L、[H2O]=3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
设830°K时,起始浓度c(CO)为amol/L、c(H2O)为bmol/L,反应达到平衡时c(H2)为cmol/L。
(1)当b不变时,a减少,重新达到平衡时,CO的转化率 ,H2O的转化率 (填“上升”、“下降”或“不变”)
(2)当a=5,c=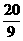 时,b=
(3)当a=b时,
时,b=
(3)当a=b时,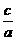 =
(4)用以表示a、b、c之间关系的代数式是
=
(4)用以表示a、b、c之间关系的代数式是
27.(5分) 25℃时,若体积为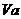 、
、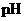 = a 的某一元强酸与体积为
= a 的某一元强酸与体积为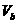 、
、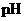 = b 的某一元强碱混合,恰好中和,且已知
= b 的某一元强碱混合,恰好中和,且已知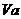 <
<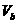 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”) ,其理由是 。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a 的取值范围__________________________________________________。
26.(9分)甲、乙、丙、丁四位同学各取了0.1 mol·L-1 的一元酸(他们所取的酸可能是不同的)20.00 mL,分别向其中滴加0.1 mol·L-1 的一元碱(他们所用的碱也可能是不同的),在滴加过程中不断测定混合液的pH,下表是测得的部分数据。
|
|
测定溶液的pH |
|||
|
加入碱溶液的体积/mL |
甲 |
乙 |
丙 |
丁 |
|
19.98 |
|
4.3 |
7.7 |
4.3 |
|
20.00 |
7.0 |
7.0 |
8.7 |
5.3 |
|
20.02 |
9.7 |
|
|
10.0 |
请回答下列问题:
(1)为了较方便准确地量取所用的酸,甲同学量取酸液时左手拿洗耳球,右手所持的玻璃量器是 (填该量器的名称),向酸溶液中滴加碱溶液时,所用的仪器是 。
(2)分析表中的数据,有一个数据肯定是错误的,该数据是 ,在回答以下问题时都应该剔除该数据。
(3)四位同学所选用的酸溶液pH最大的是 (在甲、乙、丙、丁中选填)。
(4)请计算甲同学在滴入19.98 mL 碱溶液时,溶液的pH约为 (保留一位小数,也可用对数形式表示)。
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
|
|
甲 |
乙 |
丙 |
丁 |
|
建议选用的指示剂 |
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com