
题目列表(包括答案和解析)
5.下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
 B.原电池的正极上发生氧化反应,负极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
4.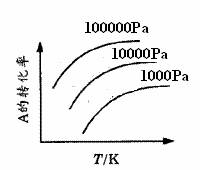 有一化学平衡mA(g)+nB(g)
有一化学平衡mA(g)+nB(g)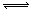 pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图可以得出的正确结论是
pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图可以得出的正确结论是
A.正反应吸热,m+n>p+q? B.正反应吸热,m+n<p+q? C.正反应放热,m+n>p+q? D.正反应放热,m+n<p+q
3.在一固定体积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 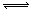 3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是
3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是
A.50a% B.35a% C.25a% D.60a%
2.把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是
A.增大亚硫酸钠粉末的量。 B.硫酸浓度增大一倍,用量减少到原来的1/2。
C.硫酸浓度不变,用量增大一倍。 D.使反应在较低温度下进行。
1.下列说法正确的是
A.焓变是指在恒压、恒温下,体系不做体积功,只做其他功的变化过程的热效应。
B.书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热。
C.化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的。
D.吸热反应的△H<0,放热反应的△H>0。
29. (8分)已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质。下面给出14种元素的电负性:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是____▲___;
(2)根据你的理解,元素的电负性指_____▲ __ ;
(3)预测Br和I元素电负性的大小关系 ▲ 。
命题:汤小梅 校对:金晶
28. (12分)有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D。已知:将0.5 mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子。当A的单质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
(1)元素符号:A___▲__,B___▲__,C__▲___,D__▲__。
(2)鉴定某物质中含有B元素的最简单的实验是__▲__。
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(用化学式表示)__▲____。
27. (8分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是__▲__(填化学式);
(2)物质E中所包含的化学键有___▲__,写出C、D两元素形成的化合物C2D的电子式__▲___;
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为_▲__ 。
27. (8分)某元素的同位素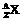 ,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值 ▲ 和A值 ▲ ;
(2)X元素在周期表中的位置 ▲ ;
(3)写出XCl2的电子式 ▲ 。
,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值 ▲ 和A值 ▲ ;
(2)X元素在周期表中的位置 ▲ ;
(3)写出XCl2的电子式 ▲ 。
26. (12分)实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
|
实验方案(只要求填写选用试剂) |
① |
② |
|
填试剂序号 |
填试剂序号 |
|
|
实验现象 |
一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 |
|
|
有关反应的离子方程式 |
|
|
|
结论 |
金属性:Mg>Al |
非金属性: |
试剂:①镁条、②铝条、③氯水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com