
题目列表(包括答案和解析)
15、在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g) 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
A.
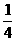 <
<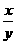 <
<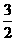 B.
B.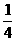 <
<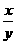 <
<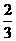 C.3<
C.3<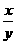 <4 D. 1<
<4 D. 1<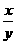 <3
<3
14、如下图,向A充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,

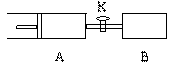 X (g)+ Y(g) 2 Z(g)+W(g);△H<0 。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是( )
X (g)+ Y(g) 2 Z(g)+W(g);△H<0 。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是( )
A.反应速率:v(B) >v(A) B.A容器中X的转化率为 80%
>v(A) B.A容器中X的转化率为 80%
C.平衡时的压强:PB > 2PA D.平衡时Y体积分数:A>B
13、NH4NO3俗名硝铵,是一种重要的化学炸药,也广泛用于农业施肥。工业上以空气、煤等原料制NH4NO3。生产过程为①生成氨②空气液化分离③氨氧化④制水煤气⑤生成HNO3⑥生成NH4NO3则最合理的流程为( )。
A. 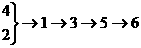 B.
B.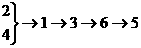
C.2→4→1→3→5→6
D. 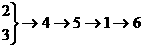
12、实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)配制纯净氯化钠溶液。下列操作可供选用: ①煮沸;②逐滴加入稀盐酸,调pH值为5;③加蒸馏水溶解;④加热至不再产生气味为止;⑤加入稍过量的BaCl2溶液;⑥加入稍过量的Na2CO3溶液;⑦过滤。
上述实验操作的正确顺序应是 ( )
A.①②⑤⑥⑦③④ B.④③⑤⑥⑦②①
C.④③⑥⑤⑦①② D.③④⑥⑤⑦①②
11、下列有关物质结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
⑤在ⅥA族元素氢化物中熔点最高的稳定性最好,而在ⅣA族元素氢化物中熔点最高的稳定性最差
⑥范德华力与化学键的区别之一是作用力的强弱不同
A.②④⑤ B.②④⑥ C.②④⑤⑥ D.②③④⑤⑥
10、下列化学反应中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成的是( )
|
B.NH4Cl + NaOH == NaCl + NH3 ↑+ H2O
|
D.SiO2 + 2C == Si + 2CO↑
9、A、B两元素的原子分别失去2个电子形成稳定结构时,A吸收的能量大于B吸收的能量;C、D两元素的原子分别得到一个电子形成稳定结构时,D放出的能量大于C放出的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是( )
A. AD2 B. BC2 C. AC2 D. BD2
8、两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的短周期主族元素中,满足上述关系的元素共有 ( )
A.4对 B.5对 C.6对 D.7对
7、下列离子方程式正确的是( )
A.Fe2O3溶于过量的氢碘酸中 Fe2O3+6H+=2Fe3++3H2O
B.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O====SO42-+ 2H+ + Cl-
C. FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2====Br2+2Fe3++4Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-====CaCO3↓+H2O
6、 将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半
将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半
透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2
min后分别取袋内和烧杯内液体进行实验。下列说法
正确的是 ( )
A.袋内液体加入硝酸银溶液后无变化 B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入碘水后不变蓝 D.烧杯内液体加入硝酸银溶液后有白色沉淀产生
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com